Применение металлокомплексов макроциклов в процессах очистки нефтепродуктов
ПРИМЕНЕНИЕ МЕТАЛЛОКОМПЛЕКСОВ МАКРОЦИКЛОВ В КАТАЛИТИЧЕСКИХ ПРОЦЕССАХ ОЧИСТКИ НЕФТЕПРОДУКТОВ
Смотрите также [PDF формат]
Металлофталоцианины являются активными и стабильными катализаторами окисления сероводорода и меркаптанов.
Большая часть нефтей и газоконденсатов СССР являются сернистыми. Сероорганические соединения ухудшают эксплуатационные свойства топлив, качество сырья для нефтехимии, оказывают сильное координирующее воздействие на технологическое оборудование. Одновременно, при дефиците серы и сероорганических соединений в стране, нефть и газоконденсаты могут быть ценными источниками для получения этих продуктов. В легких углеводородных фракциях на долю сероводорода и меркаптанов приходится основная часть сернистых соединений. Наиболее эффективным методом очистки углеводородного сырья от сероводорода и меркаптанов является их жидкофазное каталитическое окисление.
Кинетика окисления меркаптанов в присутствии дисульфофталоцианина кобальта (ДСФК) исследована на примере окисления н-бутилмеркаптана в 10%-ном водном растворе едкого натра и получено кинетическое уравнение:
-rRSNa = (K1•K2•[Kt]•[O2]•[RS-]) / (1 + Kp•[ O2])
На основании полученных результатов и литературных данных предложен анион-радикальный механизм реакции.
Реакционная способность алифатических меркаптидов натрия при их окислении кислородом в присутствии ДСФК описана корреляционным уравнением:
lgKi/K0 = -19.326 + 1.78(П-з) + 0,33 ЕSC
Изучено влияние среды на окисление меркаптидов и выбраны оптимальные концентрации щелочи, добавок полярных органических растворителей. Исследована каталитическая активность макрогетероциклических соединений в реакции окисления н-пропилмеркаптида в 10%-ом водном растворе едкого натра при температуре 30°С. В таблице 1 приведены эффективные константы скорости реакции окисления н-пропилмеркаптида в присутствии сульфопроизводных фталоцианинов различных металлов. Значительной каталитической активностью обладают только сульфопроизводные фталоцианина кобальта, что объясняется как специфичной электронной структурой металла в молекуле фталоцианина, так способностью атома кобальта к экстакоординации, а также стабильностью фталоцианинов кобальта в сильнощелочной среде.
Таблица 1. Каталитическая активность фталоцианинов металлов
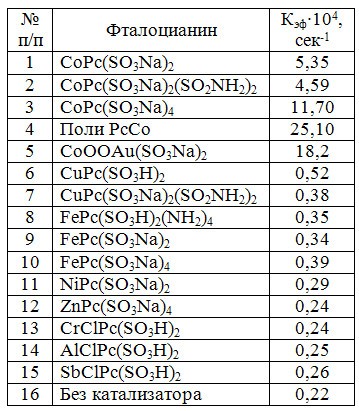
На каталитическую активность фталоцианина кобальта в значительной степени влияет и введение заместителей в бензольные ядра (табл.2), причем, введение как электродонорных (-OH, -NH2), так и электроноакцепторных (-NO2, -Br, -SO3H), приводит к усилению каталитической активности.
Таблица 2. Каталитическая активность замещенных фталоцианинов кобальта
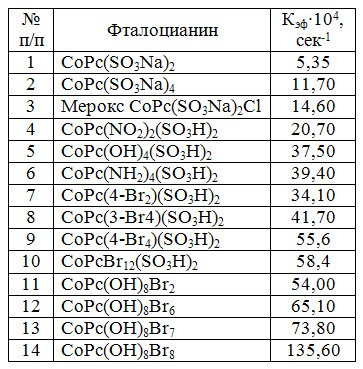
На основании проведенных кинетических исследований разработан и внедрен в промышленность процесс ВНИИУС-12 для очистки легкого углеводородного сырья (фракция С2-С6) от меркаптанов с получением диалкилдисульфидов. Процесс ВНИИУС-12 складывается из стадий экстракции меркаптанов водным раствором щелочи и каталитического окисления меркаптидов до дисульфидов кислородом воздуха с регенерацией щелочи по реакции:
2 RSNa + 0,5 O2 + H2O = RSSR + 2NaOH
Используемый катализатор хотя и обладает высокой активностью, имеет ряд недостатков в плане технологии. Поэтому нами была исследована возможность мобилизации гомогенного катализатора на полимерную основу.
Гетерогенный фталоцианиновый катализатор на полимерной основе (КС-1) был изготовлен в виде гранул (d = 4 мм) и колец Палля (50Х60Х5 мм) путем смешения несульфированного фталоцианина кобальта (20 % масс.), который не растворим в водно-щелочных растворах, и полиэтилена высокого давления в расплаве с последующей экструзией и формованием.
Уравнение для вычисления скорости н-бутилмеркаптида кислородом при атмосферном давлении на катализаторе, содержащего 20% масс. фталоцианина кобальта, имеет вид:
rRSNa = K•[RSNa]•[Kt]•[O2]
кинетическое уравнение скорости реакции окисления н-бутилмеркаптида натрия отличается от уравнения гомогенно-каталитической реакции только линейной зависимостью скорости реакции от концентрации кислорода во всем (0?100% об.) диапазоне изменения концентрации кислорода. Следовательно, и механизм гетерогенно-каталитического окисления меркаптида должен быть подобен механизму гомогенного катализа с той лишь разницей, что гетерогенный катализатор, по-видимому, образует с молекулой кислорода активированный комплекс по реакции К + О2 = [Kt….O2], где величина Кр значительно меньше. Это приводит к снижению эффективной константы скорости и линейной зависимости скорости от концентрации кислорода.
Высокомолекулярные меркаптаны, содержащиеся в дизельном топливе, плохо экстрагируются растворами щелочей и поэтому демеркаптанизация дизельного топлива сводится к прямому окислению меркаптанов в углеводородной среде до дисульфидов, которые остаются в очищенном топливе. Дисульфиды являются инертными веществами в отношении к материалам топливной аппаратуры, обладают меньшей летучестью и большей стабильностью по сравнению с меркаптанами. Более активными и технологичными для демеркаптанизации дизельного топлива являются фталоцианиновые катализаторы, нанесенные на активированные угли. Для очистки дизельного топлива от меркаптанов разработан способ окисления их до дисульфидов с использованием гетерогенного фталоцианинового катализатора – ДСФК на угле марок АГ-5, АГ-3 при температуре 50-55°С и объемной скорости подачи сырья 0,165 мин-1. В найденных оптимальных условиях были поставлены опыты по демеркаптанизации дизельного топлива Одесского НПЗ и достигнуто уменьшение меркаптановой серы от 0,02 до 0,005% масс. что в два раза ниже норм ГОСТа 305-73 по содержанию меркаптановой серы. Разработана технологическая схема для демеркаптанизации дизельного топлива на НПЗ.
Реакция жидкофазного каталитического окисления сероводорода лежит в основе промышленных процессов очистки газов от сероводорода с получением элементарной серы и обезвреживания сернисто-щелочных стоков, образующихся при щелочной очистке нефтепродуктов от сероводорода и меркаптанов.
В водно-щелочных средах, т.е. в сернисто-щелочных стоках сероводород существует в виде сульфида натрия. Следовательно, окисление сероводорода в водно-щелочной среде сводится к окислению сульфида натрия. Основными продуктами реакции в присутствии ДСФК являются тиосульфат (до 70%), сульфат натрия (до 40%), сульфит натрия и сера. Причем, в условиях эксперимента (Т=20+50°С) тиосульфат натрия окисляется незначительно, а сульфит натрия с большой скоростью. Изучена кинетика окисления сульфида натрия и кинетика реакции его совместного окисления с меркаптидом натрия в присутствии гомогенного катализатора – ДСФК и гетерогенного катализатора КС-1. Разработан процесс окислительного обезвреживания сернисто-щелочных стоков с использованием катализатора КС-1.
В среде некоторых органических амидов в присутствии металлфталоцианинов сероводород с большой скоростью окисляется количественно до элементарной серы при комнатной температуре. Кинетическое уравнение реакции имеет вид:
rH2S = K•[H2S]•[Kt]•[O2]
Окисление сероводорода, по-видимому, происходит также по анион-радикальному механизму.
В таблице 3 приведены эффективные константы скорости окисления сероводорода кислородом при температуре 15?С, концентрация катализатора 1•10-5 моль/л и начальной концентрации сероводорода 0,11 моль/л. Как видно из таблицы 3 большинство производных фталоцианина кобальта проявляют высокую каталитическую активность в реакции окисления сероводорода, также, как и в реакции окисления тиолов. Введение в молекулу ДСФК заместителей приводит к улучшению каталитической активности.
Таблица 3. Кинетическая активность фталоцианина кобальта.

В таблице 4 представлены эффективные константы скорости окисления сероводорода в присутствии сульфофталоцианинов различных металлов переменной валентности.
Таблица 4. Каталитическая активность сульфофталоцианинов металлов
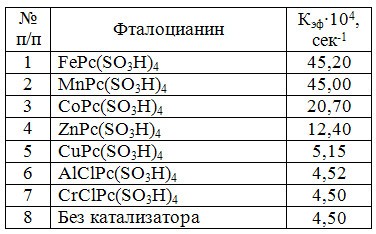
Как следует из таблицы, в отличии от реакции окисления тиолов, в реакции окисления сероводорода в диметилформамиде, высокой каталитической активностью обладают не только фталоцианины кобальта, но и фталоцианины железа и марганца. Наиболее активным из испытанных образцов оказался тетрасульфофталоцианин железа (табл.4), который предложен нами для промышленного производства и применения в качестве катализатора процесса очистки газа от сероводорода в органических растворителях.
На основании полученных результатов разработан процесс ВНИИУС-4 переработки сероводородсодержащих кислых (H2S + CO2) газов с получением элементарной серы. Внедрение процесса позволит перерабатывать 500 млн.м3/год кислых газов с содержанием сероводорода от 2 до 40% об. сжигаемых на факелах, что позволит дополнительно получить 150 тыс.т. дефицитной элементарной серы.