Синтез и свойства оксидных катализаторов окисления пространственно затрудненных фенолов
СИНТЕЗ И СВОЙСТВА ОКСИДНЫХ КАТАЛИЗАТОРОВ ОКИСЛЕНИЯ ПРОСТРАНСТВЕННО ЗАТРУДНЕННЫХ ФЕНОЛОВ
Смотрите также [PDF формат]
Аннотация
Предложен способ получения гетерогенного щелочного катализатора окисления пространственно-затрудненных фенолов на основе оксидов металлов 4-го периода таблицы Менделеева. Исследован состав предлагаемого гетерогенного щелочного катализатора. Изучены кинетические закономерности реакции окисления 2,6-ди-трет-бутилфенола.
Введение
Обеспечение производства синтетических каучуков и полиолефинов антиоксидантами, разработка безотходных способов их получения и улучшение экологической составляющей, как самих антиоксидантов, так и технологии их производства являются актуальными научно-техническими задачами. Большой теоретический и практический интерес с этих позиций представляет антиоксидант 3,3?,5,5?-тетра-трет-бутил-4,4?-дифенохинон [1, 2]. Доступным сырьем для производства является 2,6-ди-трет-бутилфенол, получаемый на ОАО Стерлитамакском нефтехимическом заводе.
С целью повышения каталитической активности гетерогенного щелочного катализатора окисления 2,6-ди-трет-бутилфенола предложенного в работах [3, 4] была изучена возмож-ность использования оксидов металлов 4-го периода таблицы Менделеева, которые, как известно, широко используются в качестве катализаторов в окислительно-восстановительных реакциях органического синтеза [5].
Экспериментальная часть
1. Синтез гетерогенного щелочного катализатора на основе оксидов металлов (далее по тексту КГЩМе). 1.0 г твердого гидроксида натрия и 0.1 г оксида металла в 50 мл декана загружали в реактор и перемешивали с помощью магнитной мешалки, увеличивая температуру раствора до заданного значения (выше 100 оС). При достижении нужной температуры раствора в реактор вводили 0.5 г 2,6-ди-трет-бутилфенола (монофенола I) и реакционную массу перемешивали не менее 30 минут. Выделяющаяся в ходе реакции вода отводилась через пробоотборное отверстие. Получаемый катализатор хранился в слое углеводородного растворителя. Размер частиц катализатора КГЩМе определяли методом просвечивающей электронной микроскопии.
2. Проведение эксперимента. В цилиндрический реактор барботажного типа загружали 50.0 мл толуола и 1.0 г катализатора КГЩМе. По достижении заданной температуры (90оС) в реактор добавляли 0.5 моль (5.0 г) монофенола I и подавали кислород с расходом 15.0 л/ч. Скорость вращения мешалки составляла 1400 об/мин.
Построение кинетических кривых осуществлялось по данным определения содержания 3,3?,5,5?-тетра-трет-бутил-4,4?-дифенохинона (дифенохинона II) в пробах фотоколориметрическим методом. По окончании опыта выключались последовательно подача кислорода и магнитная мешалка с обогревом. После полного осаждения частиц катализатора углеводородная фаза при температуре не ниже 70оС отделялась декантацией от гетерогенного катализатора КГЩМе. За полнотой осаждения катализатора КГЩМе следили по изменению окраски водной вытяжки из толуола в присутствии фенолфталеина. Углеводородный слой охлаждали до комнатной температуры, выпавший в осадок дифенохинон II отфильтровывали и сушили на воздухе.
Для работы использовались следующие химические реагенты:
Меди(II) окись (чда) по ГОСТ 16539-79
Никель(II) окись (ч) по ГОСТ 4331-78
Хрома(III) окись (ч) по ГОСТ 2912-79
Молибдена(VI) оксида (ч) по ТУ 2611-002-469133-2002
Железа(III) оксид (чда) по ГОСТ 4173-77
Кобальт оксид(II, III) (ч) по ГОСТ 4467-79
Титана(IV) окись (ч) по ГОСТ 9808-84
Цинка(II) окись (ч) по ГОСТ 10262-73
Алюминия(III) окись (чда) по ТУ 6-09-426-75
Толуол технический по ГОСТ 14710-78
2,6-ди-трет-бутилфенол по ТУ 38.103378-86
Натрия гидроокись (ч.д.а.) по ГОСТ 4328-77
Кислород технический в баллонах по ГОСТ 5583-78
Анализ катализатора методом сканирующей электронной микроскопии проводился на сканирующем электронном микроскопе EVO50 XVP фирмы ZEISS. Рентгено-флуоресцентный анализ проводился на приборе СУР-02 Реном-ФВ, режим 25 к, напря-жение родиевой трубки 25 кВт, А = 1000 mA, ? = 20 с, среда – вакуум, разделительная диаграмма = 5.0 мм2. Начальная скорость реакции определялась по тангенсу угла наклона касательной к начальному отрезку кривой накопления дифенохинона II.
Результаты и их обсуждение
Разработанный в работе [4] состав и способ приготовления гетерогенного катализатора КГЩTi обеспечивают его стабильно высокую активность в реакции окисления 2,6-ди-трет-бутилфенола молекулярным кислородом и устойчивость к воздействию влаги. Связующий агент в катализаторе КГЩTi – двуокись титана является оксидом металла переменной валентности, принадлежащего к d0 элементам 4-го периода таблицы Менделеева, обладающим низкой каталитической активностью в реакциях окислительно-восстановительного типа.
Согласно теории кристаллического поля и теории поля лигандов [5] вытекают простые соотношения между каталитической активностью и d-электронной конфигурацией катиона, привлекательные для экспериментатора. Рассмотрение большого количества реакций на катализаторах – оксидах переходных металлов – показало, что двухпиковая картина изме-нения каталитической активности оксидов d-элементов 4-го периода таблицы Менделеева с максимумами на конфигурациях d3 (Cr2O3, MnO2) и d6–d8 (Co3O4, NiO1+x) и минимума в случае конфигураций d0 (CaO, Sc2O3, TiO2), d5 (Fe2O3, MnO) и d10 (Cu2O, ZnO) подтверждается для большого числа окислительно-восстановительных реакций.
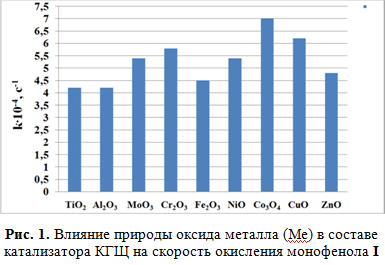
Введение в катализатор КГЩ оксидов металлов d-элементов 4-го периода таблицы Менделеева подтвердило двухпиковую картину изменения активности катализаторов КГЩМе в реакции окисления монофенола I до дифенохинона II в зависимости от природы металлов (рис. 1).
Из рис. 1 видно, что максимальная активность при окислении фенолов проявляется в случае модификации КГЩМе d6-d9 элементами (оксидом кобальта Co3O4 и оксидом меди СuO). Второй пик проявляется в случае d3-элемента (оксида хрома Cr2O3), то есть активность d3 и d6-9 систем оказалась выше, чем активность TiO2 d0 конфигурации, что согласуется с вышеописанной теорией кристаллического поля.
Константа скорости реакции окисления монофенола I в присутствии наиболее активного катализатора КГЩСо в 1.7 раза выше таковой в сравнении с катализатором КГЩTi [4] при прочих равных условиях. Изучение поверхностного состава образцов катализатора КГЩСо с применением сканирующего электронного микроскопа с фазовым элементным анализом поверхности показало (табл. 1), что поверхность катализатора КГЩСо включает в себя следующий состав основных элементов: углерод от 4.17 до 41.26 % масс., натрий от 11.80 до 43.43 % масс., кислород от 19.80 до 46.88 % масс. и кобальт от 0.36 до 62.01 % масс. Присутствие на поверхности катализатора углеводородного слоя подтверждается наличием на ней углерода. Высокое содержание натрия на поверхности гетерогенного катализатора в образцах КГЩСо (от 11.80 до 43.43 % масс.) свидетельствует о большом разбросе при заполнении поверхностного слоя катализатора гидрофобными компонентами. Места скопления оксида кобальта характеризуются яркими свечениями на снимках.
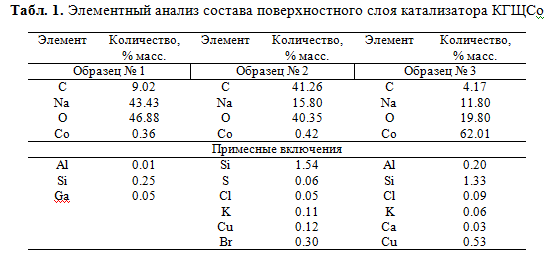
 Состав неорганических компонентов на поверхности катализатора КГЩСо был дополнительно изучен с помощью рентгено-флуоресцентного метода анализа, который также подтвердил наличие натрия и кобальта в составе изучаемого образца катализатора (табл. 2).
Состав неорганических компонентов на поверхности катализатора КГЩСо был дополнительно изучен с помощью рентгено-флуоресцентного метода анализа, который также подтвердил наличие натрия и кобальта в составе изучаемого образца катализатора (табл. 2).
Таким образом, проведенными исследованиями подтверждена высокая активность Co3O4 в составе катализатора КГЩ при окислении монофенола I в сравнении с остальными 4d элементами таблицы Менделеева и показан состав поверхности гетерогенного катализатора КГЩСо.
Далее были изучены кинетические закономерности реак-ции окисления монофенола I в присутствии КГЩСо в качестве катализатора синтеза дифенохинона II. Исследование влияния концентрации оксида кобальта в составе катализатора КГЩСо на его эффективность в реакции окисления монофенола I показало экстремальный (гиперболический) характер полученной зависимости (рис. 2), из которой следует, что оптимальное количество оксида кобальта в КГЩСо находится в пределах от 7.0 до 12.0 % масс. При концентрациях оксида кобальта в КГЩСо ниже 7.0 % масс. или выше 12.0 % масс. наблюдается резкое снижение каталитической активности модифицированного им катализа-тора.

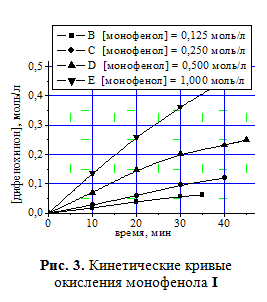
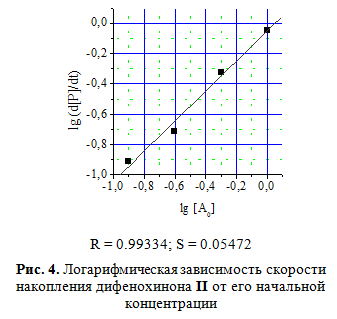
Кинетические кривые синтеза дифенохинона II при различных начальных концент-рациях монофенола I приведены на рис.3. Определение концентрационного порядка реакции дифференциальным методом показало первый порядок реакции по исходному монофенолу I (рис. 4).
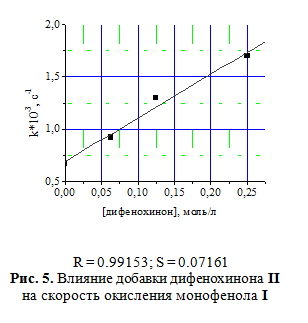
Кривые окисления монофенола I в полулогарифмических координатах не линеаризу-ются [6], что говорит о влиянии продукта реакции дифенохинона II на скорость окисления исходного фенола. Изучение влияния дифенохинона II на окисление монофенола I подтвердило его ускоряющее действие, характерное для реакций автокаталитического типа (рис. 5). Необходимо заметить, что при использовании КГЩСо отсутствует концентрационный предел увеличения концентрации дифенохинона II, после которого прекращается ускорение реакции окисления монофенола I. Увеличение скорости окисления монофенола I в присутст-вии КГЩСо прямо пропорционально увеличению концентрации дифенохинона II в системе.
Результаты исследований по подбору необходимого количества катализатора КГЩСо в реакции окисления монофенола I показали прямо пропорциональную зависимость выхода дифенохинона II от его количества. Зависимость скорости окисления монофенола I от концентрации катализатора КГЩСо хорошо описывается прямой, что свидетельствует о первом порядке реакции по катализатору.
Исследование влияния температуры на степень конверсии монофенола I показало необ-ходимость проведения данного процесса в температурном интервале от 90 до 95оС (рис. 6).
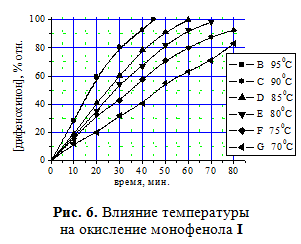

По представленным на рис. 6 данным изменения конверсии монофенола I от температуры были рассчитаны константы скорости реакции при различных температурах (табл. 3), и далее на основании зависимости lgk от 1/T рассчитана энергия активации этой реакции в присутствии катализатора КГЩСо.
Выводы
1. В соответствии с теорией кристаллического поля подтверждена активность d3 (оксида хрома Cr2O3) и d6-9 (оксидом кобальта Co3O4 и оксидом меди СuO) систем при окислении 2,6-ди-трет-бутилфенола. При этом максимальная каталитическая активность наблюдается в случае модифицирования катализатора КГЩ оксидом кобальта.
2. Выявлена оптимальная концентрация оксида кобальта в составе гетерогенного щелочного катализатора на основе оксидов металлов (КГЩСо). Подтвержден автокаталитический характер протекания реакции. Показано, что реакция окисления 2,6-ди-трет-бутилфенола (I) до 3,3?,5,5?-тетра-трет-бутил-4,4?-дифенохинона в присутствии катализатора КГЩСо протекает по первому порядку реакции, как по исходному веществу, так и по катализатору. Рассчитаны основные кинетические параметры реакции окисления монофенола I, необходимые для последующего подбора оптимальных технологических параметров процесса.
Литература
[1] Ахмадуллин Р.М., Нугуманова Г.Н., Мукменева Н.А., Бухаров С.В., Евтишина Н.М., Софронова О.В. Борейко Н.П. Каучук и резина. 2006. №10. С.14-17.
[2] R.M. Akhmadullin, G.N. Nugumanova, N.A. Mukmeneva, S.V. Bukharov, N.M. Yevtishina, O.V. Sofronova, N.P. Boreyko. International Polymer Science and Technology. 2007. Vol.34. No.1. P.T/41-T/44.
[3] Ахмадуллин Р.М., Гатиятуллин Д.Р., Агаджанян С.И., Ахмадуллина А.Г., Мукменева Н.А. Вестник казанского технологического университета. 2012. Т.15. №2. С.37-41.
[4] Ахмадуллин Р.М., Гатиятуллин Д.Р., Момзяков А.А., Агаджанян С.И., Ахмадуллина А.Г., Мукменева Н.А. Бутлеровские сообщения. 2012. Т.30. №6. С.94-97.
[5] Крылов О.В. Гетерогенный катализ: Учебное пособие для вузов. М.: ИКЦ «Академкнига». 2004. С.202-203.
[6] Панченков Г.М., Лебедев В.П. Химическая кинетика и катализ: Учебное пособие для вузов. М.: Химия. 1985. 592с.