Превращения меркаптидов в процессе каталитического окисления
ПРЕВРАЩЕНИЯ МЕРКАПТИДОВ В ПРОЦЕССЕ КАТАЛИТИЧЕСКОГО ОКИСЛЕНИЯ МОЛЕКУЛЯРНЫМ КИСЛОРОДОМ В ВОДНО-ЩЕЛОЧНЫХ РАСТВОРАХ
Смотрите также [PDF формат]
Ранее нами сообщалось [1], что в процессе обезвреживания сернисто-щелочных стоков (СЩС) на гетерогенном фталоцианиновом катализаторе КС-1 [2] сульфид окисляется в тиосульфат и сульфат, а меркаптиды – в нерастворимые в стоках органические дисульфиды. Анализ литературы по данному вопросу свидетельствует, однако, о неоднозначном протекании реакции окисления меркаптидов [3-9]. Авторы работ [3-5] считают органические дисульфиды единственным продуктом окислением меркаптидов на фталоцианиновых катализаторах. В то же время в литературе [6] показано, что при окислении 2-меркаптобензтиазола кислородом воздуха при t=600C в присутствии тетрасульфокислоты фталоцианина кобальта образуется как дисульфид, так и сульфокислота бензтиазола. По другим литературным данным [7], сульфокислота вообще является основным продуктом окисления метилмеркаптида при проведении процесса при t=800C и Р=0,9 МПа в отсутствие катализатора. При окислении тиофенола в присутствии каталитической системы хлорид меди – пиридин [8] установлено образование наряду с дисульфидом также дифенилсульфината; при окислении меркаптидов кислородом воздуха под давлением в присутствии хлорида меди в реакционной смеси найдены дисульфид и сульфокислота [9].
Поскольку реакция каталитического окисления меркаптидов воздухом лежит в основе широко используемого в промышленности процесса регенеративной демеркаптанизации сжиженных газов и бензинов [10] и обезвреживания сернисто-щелочных стоков [1], то выяснение природы образующихся при этом продуктов имеет принципиальное значение для обоснованного выбора технологического режима процесса. Наибольший интерес для исследования представляли натриевая соль дисульфофталоцианина кобальта (ДСФК), являющаяся промышленным гомогенным катализатором демеркаптанизации процесса ВНИИУС-12 [11], внедренного на нескольких предприятиях [10], а также гетерогенный промышленный катализатор КС-1 [2], используемый в настоящее время для обезвреживания сульфид- и меркаптидсодержащих СЩС.
Представляло интерес исследовать также перспективный гомогенный катализатор демеркаптанизации нефтепродуктов – дихлордиоксифталоцианин кобальта (ДХДСФК).
В связи с изложенным нами были изучены модельные реакции окисления этил-, пропил- и бутилмеркаптидов натрия в 10%-ной щелочи, имитирующие процесс демеркаптанизации сжиженных газов и бензинов, и 2%-ной щелочи, имитирующие процесс обезвреживания отработанных сернисто-щелочных растворов. Катализатор КС-1, представляющий собой композицию из 20 мас% фталоцианина кобальта и 80 мас% полиэтилена высокого давления, использовался в опытах в виде гранул диаметром 3-4 мм. Описание лабораторных установок и методики проведения опытов приведены ранее [12, 13]. Количественный анализ дисульфидов, сульфинатов и меркаптидов в щелочных растворах проводили по методикам, описанным в работах [14-16], качественный анализ – УФ и ИК спектральными методами, химическое потребление кислорода – по методике [17]. Водонерастворимые продукты окисления меркаптидов извлекали экстракцией отделенного от катализатора КС-1 оксидата гептаном или гексаном при комнатной температуре и 2-3-кратной промывкой оставшегося в реакторе катализатора КС-1 гептаном. Нагретым до 40-500С. В ИК спектрах углеводородных экстрактов оксидата и КС-1 были обнаружены только дисульфиды. Количественный анализ дисульфидов в экстракте и промывочных растворах с КС-1 показал, что основная их масса (до 80 отн%) задерживается на поверхности гидрофобного катализатора КС-1. Исследование количественного выхода дисульфидов при окислении этилмеркаптида натрия кислородом воздуха в 10%-ной NaOH было установлено (табл.1), что он не коррелирует со степенью конверсии исходной меркаптидной серы. А находится в прямой зависимости от времени контакта оксидата с окисляющим газом. Так в присутствии катализатора КС-1 выход дисульфида за 40 мин окисления составил 55% от прореагировавшей меркаптидной серы при 95%-ной конверсии последней.
ТАБЛИЦА 1
Выход диэтилдисульфида при окислении этилмеркаптида натрия t=400C, WO2=1,5 л/мин, [ДСФК]=0,005 мас%, GКС-1=45г

В присутствии гомогенного катализатора ДСФК, являющегося каталитически более активным, чем КС-1, 100%-ная конверсия этилмеркаптида наступила через 11 мин. При этом выход дисульфидов составил 73 отн%. Меньший выход дисульфидов в первом случае, по-видимому, связан с более длительным пребыванием образующихся дисульфидов в зоне реакции из-за их задержки на поверхности гетерогенного катализатора и дальнейшего окисления с образованием водорастворимых продуктов. Как видно из данных табл.1, увеличение продолжительности окисления этилмеркаптида в присутствии гомогенного ДСФК с 11 до 60 мин приводит к полному исчезновению дисульфида из оксидата. Специальными опытами на диэтилдисульфиде нами была подтверждена возможность его дальнейшего окисления кислородом воздуха как в присутствии КС-1, так и ДСФК.
Таким образом, приведенные в табл.1 результаты однозначно свидетельствуют, что в зависимости от времени окисления меркаптидов кислородом воздуха как в присутствии гетерогенного, так и гомогенного фталоцианиновых катализаторов наряду с дисульфидами могут образовываться и другие продукты более глубокого окисления дисульфидов.
Так как эти продукты являются водорастворимыми, то закономерно предположить, основываясь также на литературных данных [7-9], что это могут быть натриевые соли сульфиновой или сульфоновой кислот, которые можно выделить из оксидата в виде бариевых солей. Действительно, при добавке в оксидат катионов бария наблюдалось выпадение белого осадка, ИК спектр которого содержал полосы поглощения в области 970-1170 см-1, характеристические для солей сульфиновых и сульфоновых кислот [18]. Дополнительный УФ спектральный анализ выделенной из оксидата бариевой соли говорит об образовании преимущественно соли сульфиновой кислоты, о чем свидетельствует наличие в УФ спектре максимума поглощения в области 240-245 нм [19]. Количественный выход сульфинатной серы, найденной по методике [14], составлял от 2 до 12% от исходного содержания меркаптидной серы (табл.2). В ходе экспериментов было обнаружено, что сульфинат, так же как и дисульфид, не является конечным продуктом окисления. Через 2 сут хранения сульфинат в реакционном растворе практически отсутствовал. Как видно из данных табл.1 и 2, по мере увеличения продолжительности опытов дисбаланс между исходной меркаптидной серой и суммой идентифицированной в оксидате серы (меркаптидной, дисульфидной и сульфинатной серы) становился все более значительным. Приведенные данные указывают на образование в процессе окисления наряду с идентифицированными и других водорастворимых продуктов. Одним из таких продуктов, по литературным данным [20], мог быть алкилтиосульфонат. Для его выделения была использована методика, приведенная в работе [21]. Оксидат после экстракции дисульфида гептаном нейтрализовали соляной кислотой до рН=5 и упаривали досуха. Сухой остаток обрабатывали горячим бутанолом. Нерастворившийся при этом хлорид натрия отделяли на бумажном фильтре. При охлаждении фильтрата выпадал белый осадок, ИК спектр которого содержал интенсивные полосы с максимумами поглощения примерно при 1200, 1070 и 760 см-1 (см. рисунок). Согласно приведенным в работе [22] данным, указанные частоты поглощения являются характеристическими для фрагмента SO2S молекулы алкилтиосульфонатов. В ИК спектре продуктов окисления самого диэтилдисульфида также были обнаружены интенсивные полосы поглощения в интервале 1070-1200 см-1, характерные для тиосульфонатной группы.
ТАБЛИЦА 2
Состав продуктов каталитического окисления меркаптидов натрия Vраств=0,25л, WO2=3 л/мин, n=2000 об/мин, GКС-1=20г
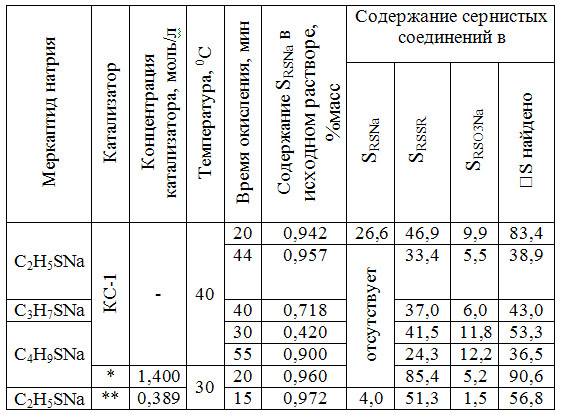
* — ФцCo(SO3H)2
** — ФцCoCl2(OH)2(SO3H)2
Анализ приведенных результатов, показывает, что продуктами окисления меркаптидов молекулярным кислородом в присутствии фталоцианиновых катализаторов в зависимости от продолжительности окисления в водно-щелочном растворе могут быть как дисульфиды, так и продукты более глубокого окисления – водорастворимые алкилсульфинаты и алкилтиосульфонаты, обладающие значительно меньшим потреблением кислорода, чем дисульфиды. Так, при увеличении продолжительности окисления с 10 до 60 мин даже в мягких условиях (при 400С и линейной скорости подачи кислорода 0,015 м/с) удается более чем в 3 раза снизить ХПК реакционного раствора (с 450 до 120 мг О2/л).
Полученные результаты свидетельствуют об определяющем значении правильности выбора времени регенерации меркаптидсодержащего раствора в процессе каталитической демеркаптанизации легкого углеводородного сырья как для нормы расхода щелочи, так и для срока службы гомогенного катализаторного комплекса. При неоправданно длительном времени проведения окислительной регенерации насыщенного меркаптидами щелочного раствора будет происходить более глубокое окисление меркаптидной серы, ведущее к нежелательному расходованию активной щелочи в случае гетерогенно-каталитической демеркаптанизации и сокращению срока службы гомогенного катализаторного комплекса.
При обезвреживании сернисто-щелочных стоков, наоборот, желательно вести реакцию окисления меркаптидов возможно глубже с целью максимального снижения токсичности стоков и химического потребления кислорода стоками.
ЛИТЕРАТУРА
1. Ахмадуллина А.Г., Мазгаров А.М. и др. //Хим. и технология топлив и масел. 1985. №5. С.36-37.
2. А.с. 1041142 (СССР). Катализатор для окисления сернистых соединений и способ его приготовления / А.М. Мазгаров, А.Г. Ахмадуллина и др.
3. Афанасьев Ю.М., Гладких А.В., Соколина Л.Ф., Бородатая Б.А. // ЖПХ. 1979. Т.52, №2. С.405-408.
4. Лешинскайте Г.И., Кундо Н.Н. и др.// ЖПХ. 1977. Т.50, №1. С. 130-133.
5. Мазгаров А.М., Фомин Н.А. // Нефтехимия. 1979. Т.19, №2. С.244-248.
6. Титова Г.Ф., Ананьева, Кузнецова Т.Е. // Изв.вузов. Сер. Хим. и хим. технология, 1981. Т.24. С-448.
7. Алферова Т.А., Титова Г.А. // Бумажная пром-ть. 1966. №10. С.5-7.
8. Brooks B.W., Smith B.M. //Chem. Ind. 1973. N.7. P. 326-329.
9. Баталина Г.М., Проскуряков В.А. // ЖПХ. 1965. Т 38, №9. С. 2078-2084.
10. Мазгаров А.М., Неяглов А.В. и др. // Химия и технология топлив и масел. 1976. №12. С. 6-8.
11. А.с. 823418 (СССР). Способ очистки углеводородного сырья от меркаптанов. А.М. Мазгаров, В.А. Фомин и др.
12. Фомин В.А. Жидкофазное окисление меркаптанов молекулярным кислородом: Автореф. канд. дис. Казань, 1980. 18с.
13. Хрущева И.К. Жидкофазное окислительное обессеривание углеводородного сырья на гетерогенном фталоцианиновом катализаторе: Автореф.канд.дис. Казань. 1986. 18с.
14. ГОСТ 22985-78. Газы углеводородные сжиженные. Метод определения сероводорода и меркаптановой серы. Введ. 1.07.79.
15. Рубинштейн Н.А. и др. // Методы анализа органических соединений нефти, их смесей и производных6: сб. 1. М.: Наука, 1970, с.74-100.
16. Губен-Вейль. Методы органической химии. Методы анализа. Т. 2. М.: Химия, 1967. 1032 с.
17. Методическое руководство по анализу сточных вод нефтеперерабатывающих и нефтехимических заводов. М.: МНХП, 1977. 594с.
18. Смит А. Прикладная ИК спектроскопия. М.: Мир, 1982. 328с.
19. Сигэру Оаэ. Химия органических соединений серы. М.: Химия, 1975. 511с.
20. Savige W.E., Maclaren J.A.//Chem. Organ. sulfur compounds. 1966. V. 2. Ch.15. S. 367-370.
21. Белоус М.А., Постовский И.Я.// ЖОХ. 1950. Т. 20, вып. 9. С. 1701-1710.
22. Simon Z., Kinath. // Z. anorg. Chem. 1961. Bd. 308, N 1-6. S. 321-323.