Определение тиосульфатной серы в окисленных сернисто-щелочных стоках
ОПРЕДЕЛЕНИЕ ТИОСУЛЬФАТНОЙ СЕРЫ В ОКИСЛЕННЫХ СЕРНИСТО-ЩЕЛОЧНЫХ СТОКАХ
Смотрите также: [PDF формат] и [PDF формат на английском языке]
В сернисто-щелочных стоках нефтеперерабатывающих предприятий наиболее вредной примесью являются неорганические сульфиды. Иногда их содержание в десятки тысяч раз превышает допустимые нормы [1]. Для обезвреживания промышленных стоков широко используют простые и эффективные окислительные методы, позволяющие частично или полностью разрушить токсичные серосодержащие соединения или перевести их в нетоксичную форму. В процессе каталитического обезвреживания сульфиды превращаются в тиосульфаты, не имеющие запаха и способные окисляться при биоочистке до безвредных сульфатов.
Существующие методы количественного определения тиосульфатов или сложны и основаны на использовании токсичных реактивов, или неселективны и требуют предварительного удаления или маскировки ряда мешающих анионов (например, иодометрический [2]). Потенциометрические методы основаны на использовании в качестве титрантов растворов токсичных ртутных солей [3, 4] и требуют предварительной маскировки формалином сульфит-иона. Косвенные методы анализа на содержание тиосульфатов [5, 6] в конечном счете сводятся к иодометрии и не лишены ее недостатков.
Нами разработан метод количественного определения тиосульфатной серы в водно-щелочных растворах титрованием 0,1н. раствором AgNO3 при рН 5-8 на потенциометре рН=340 с хлор- и сульфидсеребряным электродами. При титровании образуется слаборастворимый осадок соли серебра с исследуемым анионом. Полнота осаждения тиосульфата серебра зависит от рН среды (табл.1). При рН 5-8 достигается максимальное осаждение тиосульфата серебра и полностью исключается выпадение гидроксида серебра. Отклонение рН от указанного интервала снижает точность определения.
Таким образом, содержание тиосульфата следует определять в нейтральной или слабокислой среде. В щелочной среде азотно-кислое серебро гидролизуется с образованием осадка гидроксида серебра, вследствие чего результаты анализов получаются завышенными. Чтобы избежать этого, титрование раствором AgNO3 в щелочной среде ведут в присутствии аммиака в составе титранта или фона для титрования. Однако при определении содержания тиосульфатной серы присутствие аммиака недопустимо, так как он растворяет образующийся при титровании осадок тиосульфата серебра, что делает невозможным проведение анализа.

Нужное значение рН достигается нейтрализацией щелочной среды уксусной кислотой и определяется по индикаторной бумаге или показаниям рН-метра. При этом в растворе создается буферная среда, препятствующая значительным изменениям рН в ходе анализа. Длительность анализа 10-15 мин. Окончание осаждения тиосульфата серебра сопровождается резким изменением потенциала раствора в области 50-250 мВ (см. рисунок, кривая 1). Наличие в растворе сульфит- и сульфат-ионов, а также меркаптида и сульфида натрия, если мольные отношения их к тиосульфату не превышают соответственно 1:5 и 1:50, определению не мешают.
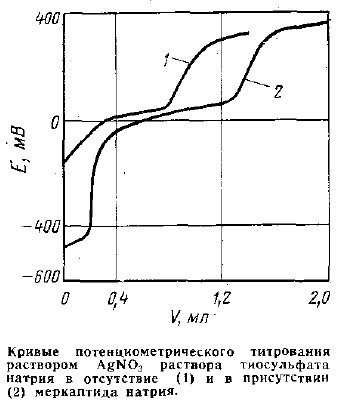
В присутствии сульфида и меркаптида натрия анализ ведут в два приема. В первой навеске определяют содержание сульфидной и меркаптидной серы потенциометрическим титрованием по ГОСТ 22985-78. Содержание тиосульфата определяют во второй навеске следующим образом. В стакан для титрования наливают 30-40 мл 1н. раствора КОН, доводят его рН до 5-7 добавлением уксусной кислоты, вводят навеску анализируемого раствора и титруют содержимое 0,1н. раствором AgNO3 на хлор- и сульфидсеребряном электродах. Исходный потенциал анализируемого раствора устанавливается в области минус 700 – минус 740 мВ при наличии неорганических сульфидов и порядка минус 450 мВ при наличии меркаптидов. Первый скачек потенциала в области минус 650 – минус 680 мВ и второй несколько выше минус 450 мВ отражают наличие в нейтральной среде остаточных количеств сульфида и меркаптида.
Содержание S (%) тиосульфатной серы определяют по скачку потенциала в области 50-200 мВ по формуле:
S = (VT/Р)100
где V – объем раствора AgNO3, пошедшего на титрование тиосульфата, мл; Т-титр раствора AgNO3 по тиосульфатной (или меркаптановой) сере, г/мл; Р – навеска анализируемого вещества, г.
Объем V при наличии в исследуемой пробе сульфида или меркаптида определяют как разность между объемами титранта, пошедшего на титрование всех серосодержащих соединений и сульфида и (или) меркаптида натрия из второй навески (см. рисунок, кривая 2).
При отсутствии в анализируемой смеси сульфида и меркаптида натрия анализ ведут в один прием описанным способом. Исходный потенциал раствора в этом случае устанавливается в пределах минус 100 – минус 200 мВ. Данные статистической обработки результатов определения содержания тиосульфата натрия потенциометрическим титрованием при числе определений n=5 и рН 7 приведены в табл.2. Как видно. Стандартное отклонение результатов определения в рекомендуемом интервале концентраций не превышает 0,008. Математическую обработку результатов определения проводили в соответствии с рекомендациями ИЮПАК [7].

Предлагаемая методика пригодна для определения группового состава серосодержащих соединений в промышленных сточных водах, для анализа окисленных сернисто-щелочных стоков, сбрасываемых на биоочистку, а также при кинетических исследованиях реакций окисления неорганических серосодержащих соединений. При определении по данной методике содержания тиосульфатной серы в сернисто-щелочных стоках Туапсинского НПЗ после окислительного обезвреживания в лабораторных условиях стандартное отклонение не превышало 6%. Найденное потенциометрическим титрованием содержание тиосульфатной серы составило 3,75% (масс.), а иодометрическим методом – 4,12 % (масс.).
СПИСОК ЛИТЕРАТУРЫ
1. Рудин М.Г., Арсеньев Г.А., Васильев А.В. Общезаводское хозяйство нефтеперерабатывающего завода. Л., Химия, 1978. – 311 с.
2. Лурье Ю.Ю., Рыбникова А.И. Химический анализ производственных сточных вод. М., Химия, 1974, с.92.
3. РЖ «Химия», 1977, 7178.
4. Havas J. – Hung. Sci. Instrum., 1973, N 5, p. 35-37.
5. А.с. 548808 (СССР).
6. Kilroy W.P. – Talanta, 1978, v.25, N 6, p. 359-362.
7. Феннел Р.В., Уэст Т.С. – Журнал аналитической химии, 1971, т. 26, №5, с. 1021-1023.