Кинетика совместного окисления сульфида и меркаптида натрия
КИНЕТИКА СОВМЕСТНОГО ОКИСЛЕНИЯ СУЛЬФИДА И МЕРКАПТИДА НАТРИЯ В ПРИСУТСТВИИ ДИСУЛЬФОФТАЛОЦИАНИНА КОБАЛЬТА
Смотрите также [PDF формат]
Сернистые соединения в легком углеводородном сырье (фракция С2-С6) представлены в основном сероводородом и меркаптанами. При щелочной очистке углеводородов они удаляются совместно в виде сульфидов и меркаптидов, образуя сернисто-щелочные стоки (СЩС), в которых концентрация сернистых соединений многократно превышает ПДК для стоков, направляемых на биоочистку. Отсюда возникает необходимость предварительного обезвреживания СЩС. Наиболее простым и перспективным методом обезвреживания является их жидкофазное окисление воздухом.
В литературе практически отсутствуют данные по этому вопросу. Авторы работы [1], проводя окисление в водно-спиртовых растворах в присутствии тетрасульфофталоцианина кобальта, установили, что совместное присутствие этилмеркаптана и сероводорода ускоряет окисление обоих компонентов. За скоростью реакции авторы следили по поглощению кислорода, что не позволяет судить о взаимном влиянии реагентов на скорость окисления друг друга. Однако приведенные данные свидетельствуют об усложнении кинетики процесса при одновременном окислении сульфида и меркаптида натрия.
Настоящая работа посвящена изучению кинетики совместного окисления н-бутилмеркаптида и сульфида натрия молекулярным кислородом в растворе едкого натра в присутствии дисульфофталоцианина кобальта.
Окисление н-бутилмеркаптида и сульфида натрия проводили при атмосферном давлении техническим кислородом в 5%-ном водном растворе едкого натра на установке периодического действия. В качестве реактора использовали стеклянный цилиндрический сосуд объемом 200 мл, снабженный турбинной мешалкой, отражательными перегородками, барботером, обратным холодильником и контактным термометром, соединенным с электронным реле. Обогрев реактора осуществляли с помощью нихромовой спирали, температуру регулировали с точностью ±0,20. В эксперименте использовали сульфид натрия марки ч.д.а. без предварительной очистки, н-бутилмеркаптан марки «чистый», очищенный перегонкой, едкий натр марки х.ч., элементарную серу марки ос. ч. и технический дисульфофталоцианин кобальта (ДСФК), выпускаемый химическим заводом по ТУ 614-30-75.
Раствор н-бутилмеркаптида натрия готовили смешением н-бутилмеркаптана с 5%-ным водным раствором едкого натра. Перед началом опыта к раствору меркаптида добавляли сульфид натрия. Катализатор предварительно растворяли в дистиллированной воде. Смешение растворов и подогрев реакционной массы проводили в атмосфере аргона. После достижения заданной температуры в реактор подавали кислород, и этот момент принимали за начало реакции. За ходом окисления следили по изменению концентраций меркаптида и сульфида натрия, определяемых потенциометрическим титрованием на приборе рН-340 по известной методике [2]. В отбираемых пробах также определялось содержание тиосульфата и сульфита натрия иодометрическим титрованием [3], сульфата натрия – комплексонометрическим титрованием [4]. Опыты проводили в кинетической области протекания реакции. Во всех опытах концентрацию катализатора пересчитывали на 100%-ный дисульфофталоцианин кобальта.
Предварительными опытами было показано, что при температуре 300С в присутствии катализатора скорость окисления сульфида и меркаптида натрия при совместном их присутствии незначительна, ею можно пренебречь по сравнению со скоростью каталитической реакции.
В ходе работы был проведен балансовый опыт. Так как из литературы известно, что единственным продуктом окисления меркаптана в щелочной реде является диалкилдисульфид [5,6], то материальный баланс сводился только по сульфиду натрия и продуктам его окисления. Балансовый опыт проводили при температуре 300С, начальных концентрациях сульфида и меркаптида натрия по 0,1 моль/л, катализатора 1•10-6 моль/л. Материальный баланс реакции по сере соблюдается достаточно корректно по уравнению:
[Na2S]0 = [Na2S] + [Na2S2O3] + [Na2SO3] + [Na2SO4] + S0
На рис.1 приведены кинетические кривые расходования сульфида и меркаптида натрия при совместном и индивидуальном окислении. Из графиков хорошо видно, что при совместном окислении скорость расходования меркаптида натрия увеличивается, а сульфида натрия замедляется. Характер кривой расходования Na2S говорит о том, что интенсивное окисление его начинается с того времени, когда большая часть меркаптида израсходовалась.
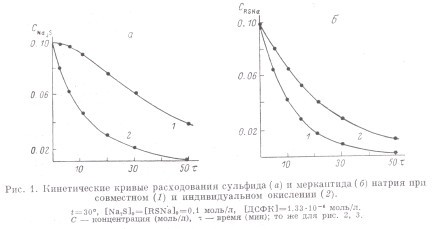
В связи с наблюдаемыми изменениями при переходе к совместному окислению сульфида и меркаптида натрия было изучено влияние продуктов окисления сульфида натрия на скорость расходования меркаптида натрия и, наоборот, влияние дибутилдисульфида на скорость расходования Na2S. Ранее было показано [6], что дибутилдисульфид не оказывает влияния на скорость окисления н-бутилмеркаптида натрия. Продукты окисления сульфида натрия (тиосульфат, сульфит и сульфат натрия) не влияют на скорость его расходования [7]. Поэтому изучали влияние продуктов окисления Na2S на скорость расходования меркаптида натрия. Опыты проводили при температуре 300С. Концентрации катализатора 1,33•10-6 моль/л. Оказалось, что продукты окисления сульфида натрия также не оказывают влияния на скорость расходования меркаптида натрия. Добавки дибутилдисульфида не влияют на окисление Na2S.
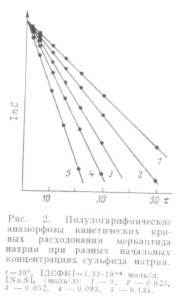 Опыты с варьированием начальной концентрации сульфида натрия показали, что окисление меркаптида натрия протекает в соответствии с кинетикой реакции первого порядка, и увеличение концентрации сульфида натрия ускоряет расходование меркаптида натрия (рис.2). причем увеличение скорости окисления RSNa пропорционально отношению начальной концентрации Na2S к начальной концентрации RSNa. Увеличение начальной концентрации меркаптида натрия приводит к замедлению расходования Na2S.
Опыты с варьированием начальной концентрации сульфида натрия показали, что окисление меркаптида натрия протекает в соответствии с кинетикой реакции первого порядка, и увеличение концентрации сульфида натрия ускоряет расходование меркаптида натрия (рис.2). причем увеличение скорости окисления RSNa пропорционально отношению начальной концентрации Na2S к начальной концентрации RSNa. Увеличение начальной концентрации меркаптида натрия приводит к замедлению расходования Na2S.
В работах [6,7] было показано, что скорости окисления сульфида и меркаптида натрия пропорциональны начальной концентрации катализатора. Зависимости скоростей окисления сульфида и меркаптида натрия от концентрации кислорода в газе-окислителе линеаризируется в координатах 1/r0-1/РО2, что позволяет описывать зависимость скорости реакции от концентрации кислорода уравнением вида:
r0 = A[O2] / (1 + B[O2])
Дополнительными опытами было показано, что при t=300C в отсутствие кислорода меркаптид натрия быстро реагирует с элементарной серой по реакции:
2RSNa + S RSSR + Na2S
Ранее [7] сообщалось, что в процессе окисления сульфида натрия образуется и накапливается элементарная сера. При совместном окислении сульфида и меркаптида натрия она расходуется, взаимодействуя с меркаптидом натрия и давая диалкилдисульфид и сульфид натрия по описанной выше реакции. Поэтому ее концентрация поддерживается на низком, практически постоянном уровне. Ускорение расходования меркаптида натрия в данном случае по сравнению с его индивидуальным окислением объясняется тем, что он расходуется как по реакции его с кислородом, так и по реакции с серой. По этой же реакции происходит образование сульфида натрия, и это приводит к кажущемуся замедлению его расходования.
Обработка кинетических данных проводилась интегральным методом на ЭВМ. Учитывая, что реакция окисления меркаптида натрия имеет первый порядок по RSNa и катализатору, а зависимость скорости реакции от концентрации кислорода имеет вид дробно-линейной функции, уравнение расходования меркаптида натрия можно записать следующим образом.
Первый член этого уравнения учитывает расходование меркаптида натрия по реакции с кислородом, он описывает индивидуальное окисление RSNa. Второй член этого уравнения учитывает расходование меркаптида натрия по реакции с серой, образование которой принимаем пропорциональным отношению [Na2S]0/[RSNa]0. По этой же реакции происходит образование сульфида натрия со скоростью. В 2 раза меньшей, чем скорость расходования меркаптида натрия.
В работе [7] было показано, что скорость окисления сульфида натрия прямо пропорциональна начальным концентрациям дисульфофталоцианина кобальта. Уравнение расходования сульфида натрия будет иметь следующий вид:
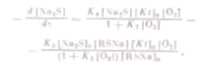
Полученная система уравнений удовлетворительно описывает все имеющиеся экспериментальные результаты (рис.3).
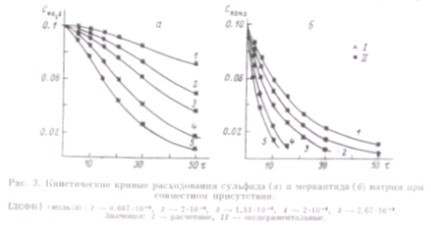
Константы К2 и К4 были определены ранее независимо при индивидуальном окислении сульфида натря: К2=0,250±0,005 атм-1, К4=25000±1000 л/(атм•моль•мин). Константа К1=35000±2000 л/(атм•моль•мин) является константой скорости окисления индивидуального н-бутилмеркаптида натрия. При совместном окислении подбиралась константа К3, значение которой равно К3=24000±2000 л/(атм•моль•мин).
Используя данные окисления индивидуального сульфида и меркаптида натрия и данные их совместного окисления, можно предложить следующую кинетическую схему.
1. Активация кислорода при образовании лабильного комплекса катализатора с кислородом:
![]()
2. Взаимодействие этого комплекса с субстратами:
![]()
Рекомбинация RS* приводит к образованию диалкилдисульфида – продукта окисления меркаптида натрия.
Дальнейшее превращение HS* приводит к образованию полисульфидов, которые легко окисляются до более стабильных продуктов. Полисульфиды с длинной цепью также распадаются с образованием элементарной серы, которая взаимодействует с меркаптидом натрия с образованием дибутилдисульфида и сульфида натрия.
Предложенный механизм окисления является общим как для индивидуального окисления Na2S и RSNa, так и для их совместного окисления, что подтверждается и общим видом кинетических уравнений и соответствием значений кинетических констант.
ЛИТЕРАТУРА
1. Лещинскайте Г.И., Кундо Н.Н., Чернова В.Г. – ЖПХ, 1977, т.50, №1, с. 130-133.
2. Колчина Н.А., Кондратьев Г.М. – ЖАХ, 1969, т. 24, №12, с. 1884-1889.
3. Лурье Ю.Ю., Рыбникова А.И. Химический анализ производственных сточных вод. М.: Химия. 1974. 335 с.
4. Szal J., Cyganski A. – Wiadomosci cheiczne, 1972, z. 26, N 10, s. 685-705.
5. Wallace T.J., Schriesheim A., Hurwitz H., Glaser M.B. – Ind. Eng. Chem. Proc. Des. Develop., 1964, vol. 3, N 3, p.237-241.
6. Мазгаров А.М., Фомин В.А. – Нефтехимия, 1979, т. 19, №2, с. 244-248.
7. Овсянникова Л.В., Мазгаров А.М., Дигуров Н.Г. – Деп. в ВИНИТИ АН СССР, №6157-82 от 15 декабря 1982г.