Каталитическая активность оксидов металлов переменно валентности
КАТАЛИТИЧЕСКАЯ АКТИВНОСТЬ ОКСИДОВ МЕТАЛЛОВ ПЕРЕМЕННОЙ ВАЛЕНТНОСТИ, НАНЕСЕННЫХ НА ПОЛИМЕРНУЮ МАТРИЦУ, В РЕАКЦИИ ОКИСЛЕНИЯ ГИДРОСУЛЬФИДА НАТРИЯ
Смотрите также [PDF формат]
На предприятиях нефтеперерабатывающей и нефтехимической промышленности одна из основных экологических проблем связана с необходимостью обезвреживания или утилизации загрязненных сернистыми соединениями отработанных щелочных растворов и водных технологических конденсатов (ТК), составляющих сернисто-щелочные стоки (СЩС).
СЩС представляют собой водные растворы натриевых солей разной концентрации: гидросульфидов, сульфидов, меркаптидов, карбонатов, сульфатов, а также фенолятов натрия и водорастворимых или эмульгированных нефтепродуктов [1].
СЩС обезвреживают, в основном, путем окисления содержащихся в них токсичных сернистых соединений в менее токсичные продукты электрохимическим способом или с помощью химических окислителей [1, 2]. Из этих методов наибольший интерес представляет окисление токсичных сернистых соединений кислородом воздуха из-за его доступности и невысокой стоимости.
В отсутствие катализаторов процесс окисления кислородом осуществляется при температуре 90-1100С и давлении 0,3-0,5 МПа [3]. Использование катализаторов позволяет интенсифицировать окисление. Каталитической активностью в этом процессе облада-ют соли металлов переменной валентности, такие, как Ni, Mn, Cu, Co, Fe [4].
В процессе обезвреживания СЩС целесообразно использовать гетерогенные катализаторы, каталитически активные компоненты которых не уносятся с очищаемыми стоками, а носитель катализатора является устойчивым к воздействию щелочи и примесям нефтепродуктов, содержащихся в СЩС. Таким требованиям отвечают катализаторы серии КС на полимерной матрице [5,6,7], хорошо зарекомендовавшие себя в промышленности, основным каталитическим компонентом которых являются дорогостоящие фталоцианины металлов переменной валентности. Для расширения ассортимента, повышения активности и удешевления гетерогенных катализаторов в процессах локального каталитического обезвреживания СЩС представлялось целесообразным испытание потенциально активных в реакциях окисления и не растворимых в воде оксидов металлов переменной валентности, нанесенных на полимерную матрицу.
1. Экспериментальная часть.
Приготовление катализатора осуществлялось введением в полимерную матрицу оксидов металлов переменной валентности по методу [8]. Концентрация оксидов метал-лов образцов катализатора представленных на рис. 1 составляла 5,0 % масс. В остальных образцах концентрация каталитического компонента в полиэтилене соответствовала цифре, обозначенной через дефис (Пр. CuO-20 – образец катализатора с содержанием оксида меди – 20 % масс). Промышленный катализатор сероочистки КС-20 соответствовал 20%-ой концентрации фталоцианина кобальта в полиэтилене.
В качестве полимерного носителя использовался полиэтилен высокого давления КАЗПЭЛЕН марки 15313-003 по ГОСТ 16337-77. Гетерогенный катализатор представлял собой кубики, размером 2х2х2 мм.
Для работы использовались следующие оксиды металлов переменной валентности:
Марганец (IV) окись (ч) по ГОСТ 4470-79, изм 1-2.
Меди (II) окись (чда) по ГОСТ 16539-79.
Никель (II) окись (ч) по ГОСТ 4331-78.
Титана (IV) окись (ч) по ГОСТ 9808-84.
Ванадия (V) окись (ч) по МРТУ 6-09-6594-70.
Хрома (III) окись (ч) по ГОСТ 2912-79.
Молибдена (VI) оксида (ч) по ТУ 2611-002-469133-2002.
Железа (III) оксид (чда) по ГОСТ 4173-77.
Кобальт оксид (II, III) (ч) по ГОСТ 4467-79.
Фталоцианин кобальта ТУ 6-07-1135-78.
Гидросульфид натрия, CAS:207683-19-0, ACROS, New Jersey, USA.
Испытуемые растворы приготавливали разбавлением твердого гидросульфида натрия в воде.
Окисление NaSН в водном растворе проводилось в цилиндрическом реакторе барботажного типа. Кислород со cкоростью 6,0 – 84,0 л.час-1 подавался в реакционный раствор с заданной концентрацией NaSН в присутствии испытуемого катализатора. Раствор в реакторе перемешивали со скоростью 1400 об. мин-1. Температура реакционного раствора поддерживалась на уровне 60°C с помощью терморегулируемой магнитной мешалки.
Начальная скорость реакции определялась по тангенсу угла наклона касательной к начальному отрезку кривой исчезновения гидросульфида натрия. Исходная концентрация NaSН варьировалась от 0,4 до 1,5 %масс. Концентрация NaSН в растворе определялась потенциометрическим титрованием по ГОСТ 22985-90.
2. Результаты и обсуждение.
2.1 Влияние природы оксидов металлов переменной валентности на окисление NaSH.
Гетерогенные катализаторы на основе оксидов металлов переменной валентности нашли широкое применение как в реакциях парциального окисления, так и глубокого окисления углеводородов, H2S, NH3 и т.д. [9]. Проведенное нами исследование ээффективности окисления гидросульфида натрия в водном растворе в присутствии оксидов переходных металлов, нанесенных на полимерную матрицу, показано на рис. 1.
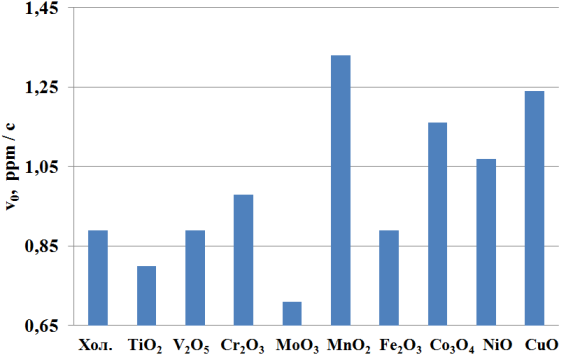
Рис. 1 Влияние природы окислов металлов, нанесенных на полимерную матрицу на начальную скорость окисления (?0) гидросульфида натрия.
Максимальную активность при окислении растворов гидросульфида натрия кислородом проявляют каталитализаторы с MnO2 и CuO, в присутствии которых начальные скорости окисления гидросульфида натрия в 1,8 и 1,6 раз выше (рис.1) по сравнению с холостым опытом. Катализаторы на основе оксидов металлов переменной валентности: NiO, Co3O4, Cr2O3 — проявляют незначительную активность, часть из испытанных оксидов: V2O5, Fe2O3 — не влияют на скорость окисления гидросульфида натрия, а катализаторы на основе TiO2 и MoO3 — даже ингибируют окисление NaSH.
Полученные результаты согласуются с теорией двустадийного окислительно-восстановительного механизама, предложенного П.Марсом и Д.Кревеленым [9]. Согласно этой теории на скорость каталитической реакции влияют 2 фактора:
1. скорость восстановления катализатора, зависящая от энергии связи кислород???катализатор (Кат???О):
Кат???О + R ? RO + Кат
При этом активность окислов металлов расположена в следующем порядке [10]:
Co3O4>CuO>NiO>Mn2O3>Cr2O3>Fe2O3>ZnO>V2O5>TiO2
2. скорость образования комплекса кислород???катализатор (Кат???О), зависит от скорости адсорбции кислорода на поверхности оксидов:
2Кат + О2 ? 2Кат???О
В этом случае ряд активности оксидов металлов переходной валентности расположен в следующей последовательности [11]:
CuO>Co3O4>NiO
Проявление высокой активности оксида марганца (IV) в реакции окисления гидросульфида натрия (рис. 1) можно объяснить его вкладом как окислителя в начальный момент реакции и как катализатора на протяжении самой реакции [12]. Косвенно это подтверждается тем, что катализатор на основе MnO2 значительно увеличивает скорость окисления NaSH в начальный период реакции (в течение первых 30-мин.), в то время как в присутствии композиции с CuO скорость окисления гидросульфида натрия остается постоянной во времени.
Основываясь на максимальной активности катализаторов с оксидом меди (II) и оксидом марганца (IV) были выполнены исследования по подбору оптимального соотношения активных окислов CuO, MnO2 в смесевой композиции друг с другом в составе полимерной матрицы. Максимальная концентрация каталитического компонента в полимерной матрице составила 20% масс. Результаты испытаний представлены на рис. 2.
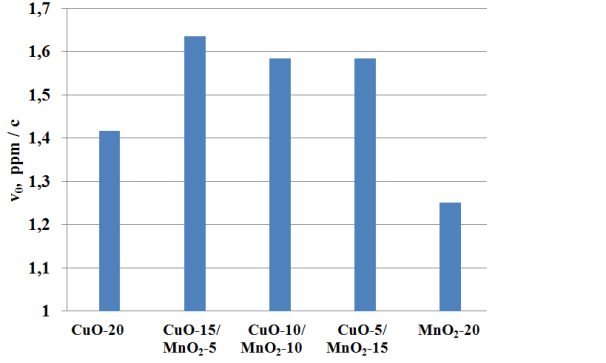 Рис. 2 Зависимость начальных скоростей окисления (?0) от соотношения CuO?MnO2 в составе катализатора.
Рис. 2 Зависимость начальных скоростей окисления (?0) от соотношения CuO?MnO2 в составе катализатора.
Из представленных графиков видно, что наибольшей активностью в реакции окисления NaSH обладают смесевые катализаторы следующего состава: CuO-15/MnO2-5 (1.635 ррм.с-1), CuO-10/MnO2-10 (1.58 ррм.с-1), CuO-5/MnO2-15 (1.58 ррм.с-1).
Сравнение каталитической активности известного фталоцианинового катализатора КС-20, основным каталитическим компонентом которого является 20%-ый концентрат фталоцианина кобальта в полимере, показало, что катализатор MnO2-5/CuO-15 обладает более высокой активностью (?0 = 1,635 ppm/c) при окислении гидросульфида натрия в сравнении с известным катализатором КС-20 (?0 = 1,35 ppm/c).
2.2 Изучение реакции окисления NaSH в присутствии гетерогенного катализатора на основе окислов марганца и меди
Далее, с катализатором MnO2-5/CuO-15, проявившего наибольшую активность в реакции окисления гидросульфида натрия, было исследовано влияние концентрации каталитического компонента в полимерной матрице и его количества в реакции окисления NaSH, а также определены порядки реакции по кислороду и исходному гидросульфиду натрию.
Исследование влияния концентрации каталитического компонента –окислов марганца и меди (при соотношении MnO2:CuO=1:3) в полимерной матрице показывает (рис.3), что с ее увеличением скорость реакции окисления гидросульфида натрия растет в диапазоне от 0 до 15%. Дальнейшее увеличение концентрации окислов не влияет на скорость окисления NaSH, что связано, видимо, с насыщением геометрической поверхности катализатора активными центрами.
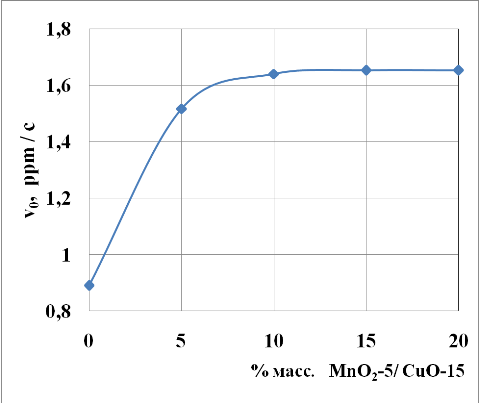
Рис. 3 Зависимость начальных скоростей окисления (?0) от концентрации окислов марганца и меди (при соотношении MnO2:CuO=1:3) в полимерной матрице.
Изучение влияния количества гетерогенного катализатора на скорость окисления NaSH показывает (рис.4), что при увеличение массы катализатора до 5,0 г скорость реакции окисления NaSH растет. Дальнейшее увеличение количества катализатора не влияет на скорость реакции. Отсутствие увеличения скорости реакции с ростом количества катализатора, по-видимому, связано с лимитированием гидродинамики перемешивания в самом реакторе.
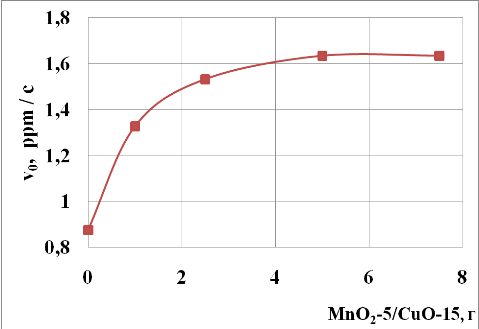
Рис. 4 Зависимость начальных скоростей окисления (?0) от массы катализатора MnO2-5/CuO-15 в реакционной смеси.
В отсутствии катализатора повышение температуры и давления увеличивает скорость и глубину окисления сульфидов и гидросульфидов, не изменяя механизм реакции [13]. Влияние температуры на скорость окисления гидросульфида натрия в присутствии катализатора MnO2-5/CuO-15 показано на рис. 5. Максимальная скорость окисления NaSH наблюдается при температуре 600С, выше которой скорость окисления NaSH снижается, что, по-видимому, объясняется снижением растворимости кислорода в водной среде с ростом температуры.
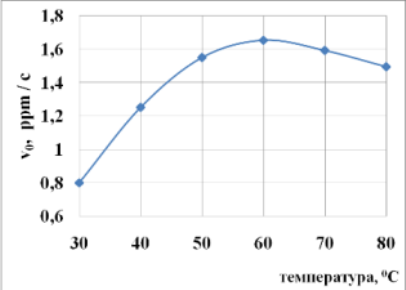
Рис. 5 Зависимость скорости окисления NaSH от температуры в присутствии катализатора MnO2-5/CuO-15.
Определение порядка реакции окисления NaSH по кислороду в присутствии ката-лизатора MnO2-5/CuO-15 дифференциальным методом показало первый порядок реакции (рис. 6). При изучение порядка реакции по гидросульфиду натрия (рис.7) было обнаружено, что начальная скорость реакции не зависит от концентрации исходного NaSH. Представленные данные свидетельствуют о реакции нулевого порядка.
Полученные результаты (первый порядок реакции по кислороду, нулевой порядок по NaSH) показывают, что эффективность окисления катализатором не зависит от концентрации NaSH, и возрастет с увеличением концентрации кислорода в газе. Таким образом, реакция окисления гидросульфида натрия лимитируется растворимостью кислорода в водной среде, количеством активных центров на поверхности катализатора и количеством (поверхностью) катализатора.
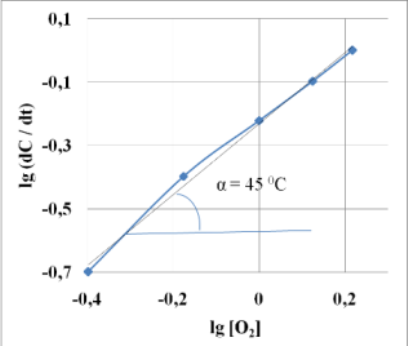
Рис. 6 Логарифмическая зависимость скорости каталитического окисления NaSH от концентрации О2 в присутствии катализатора MnO2-5/CuO-15 при 60?С.

Рис. 7 Зависимость начальной скорости окисления NaSH от его исходной концентрации в присутствии катализатора MnO2-5/CuO-15.
На основе представленных данных можно предположить следующий механизм реакции окисления сернистых соединений:
Mn4+ + SH? ? Mn3+ + SH? (1)
2 SH? ? HSSH (2)
Cu2+ + Mn3+ ? Cu+ + Mn4+ (3)
Cu+ + O2 ? Cu2+ + O2? (4)
Первые две стадии протекают с высокой скоростью, что подтверждается нулевым порядком реакции по исходным сернистым соединениям. Стадия (3) протекает из доказанной авторами [14, 15] электронной передачи между катионами меди и марганца в смеси однофазных оксидов MnO2/CuO. В связи с этим, по-видимому, наблюдается проявление синергетического эффекта активности смесевого катализатора (см. рис. 2). Лимитирующей стадией (4) первого порядка является активация кислорода и окисление иона меди.
Список литературы:
1. Ахмадуллина, А.Г. Обезвреживание и использование сернисто-щелочных отходов нефтепереработки и нефтехимии. А.Г. Ахмадуллина, Ю.Р. Абдрахимов, И.Н. Смирнов. – Тематический обзор ЦНИИТЭнефтехим, выпуск 4, М. 1990, 50 стр.
2. Галуткина, Г.А., Использование метода химического окисления в процессе очистки сточных вод нефтеперерабатывающих и нефтехимических производств. Г.А. Га-луткина, А.Г. Немченко, Э.В. Рубинская – М.: Тематический обзор ЦНИИТЭнефтехим, 1979. – 44 с.
3. Пат. 2008971 Российская Федерация МПК7 B01J23/86. Способ окисления сернистых соединений в сточных водах / Ахмадуллина А.Г., Куницын Б.М.; Абрамова Н.М.; Кудрявцев Б.В.; Нургалиева Г.М.; Хрущева И.К. заявитель и патентообладатель ВНИИУС. — № 4934793/04, заявл. 12.05.1991; опубл. 15.03.1994.
4. Michael, R. / Environ science and Technology. R. Michael – 1979. – V.13. – No.11. – P.1406-1414.
5. Ахмадуллина, А.Г. О новых разработках и внедрениях в области сероочист-ки углеводородного сырья. А.Г. Ахмадуллина, Р.М Ахмадуллин. Химия и технология то-плив и масел. Т.44. №6, 2008
6. Ахмадуллина, А.Г. Гетерогенно-каталитическая демеркаптанизация легкого углеводородного сырья. А.Г. Ахмадуллина, Б.В.Кижаев, Г.М.Нургалиева, А.С.Шабаева, С.О.Тугуши, Н.В.Харитонов. Нефтепереработка и нефтехимия, №2, 1994, с.39.
7. Ахмадуллина, А.Г. Гетерогенно-каталитическое окисление 2,6-ди-трет-бутил-фенола до 3,3?,5,5?-тетра-трет-бутил-4,4?-дифенохинона с использованием поли-мерного катализатора на основе тетрахлорфталоцианина кобальта. А.Г. Ахмадуллина, Р.М. Ахмадуллин, С.И. Агаджанян, Н.А. Мукменева. Вестник технологического универ-ситета. – 2009. – №2. – С. 64-70.
8. А.С. № 1041142, Бюл № 34, 1983. Катализатор для окисления сернистых соединений и способ его приготовления. А.Г. Ахмадуллина, А.М.Мазгаров, М.И.Альянов, В.В.Калачева, И.К.Хрущева, Г.М.Нургалиева, Г.А.Остроумова, А.Ф.Вильданов.
9. Крылов, О.В. Гетерогенный катализ: Учебное пособие для вузов / О.В. Крылов. М.: ИКЦ «Академкнига», 2004. – 679 с.
10. Боресков, Г. К., /Докл. АН СССР. Г.К. Боресков, В.И. Маршнева— 1973.— Т. 213, № 1.— С. 112—115.
11. Halpern, В., / Compt. rend. B. Halpern, J. E. Germain — 1973.— T. 277, N 24.— P. 1287—1290.
12. Valeika, V. Oxidation of sulphides in tannery wastewater by use of manganese (IV) oxide. V. Valeika. Polish J. of Environ. Stud. Vol. 15 No 4. 2006, 623-629.
13. Алферова, Л.А. Химическая очистка сточных вод в производстве сульфат-ной целлюлозы. Л. А. Алферова, А. А. Алексеев. М.: Лесная промышленность, 1968, 105 с.
14. Veprek, S. Mechanism of the deactivation of Hopcalite catalysts studied by XPS, ISS, and other techniques S. Veprek, D.L. Cocke, S. Kehl and H.R. Oswald, J. Catalysis, V.100, Issue 1, July 1986, P. 250-263.
15. Buciuman, F.C. A spillover approach to oxidation catalysis over copper and man-ganese mixed oxides. F.C. Buciuman, F. Patcas, T. Hahn. Chem. Eng. Proc. 38 (1999) P. 563-569.