Гетерогенно-каталитическое окисление 2,6-ди-трет-бутилфенола
ГЕТЕРОГЕННО-КАТАЛИТИЧЕСКОЕ ОКИСЛЕНИЕ 2,6-ДИ-ТРЕТ-БУТИЛФЕНОЛА ДО 3,3?,5,5?-ТЕТРА-ТРЕТБУТИЛ-4,4?-ДИФЕНОХИНОНА С ИСПОЛЬЗОВАНИЕМ ПОЛИМЕРНОГО КАТАЛИЗАТОРА НА ОСНОВЕ ТЕТ-РАХЛОРФТАЛОЦИАНИНА КОБАЛЬТА
Смотрите также [PDF формат]
Ранее проведенными работами [1] показана эффективность использования 3,3?,5,5?-тетра-третбутил-4,4?-дифенохинона в качестве стабилизатора синтетических каучуков об-щего назначения СКИ, СКД и др. Отсутствие экологичной технологии их получения пре-пятствует внедрению промышленного производства данного стабилизатора в России. Учитывая наличие отечественной сырьевой базы (2,6-ди-трет-бутилфенола) для синтеза этих антиоксидантов и перспективность их использования в промышленности СК, актуальным является продолжение исследований, посвященных разработке малоотходной технологии их синтеза.
Данное исследование направлено на разработку гетерогенно-каталитического про-цесса синтеза 3,3?,5,5?-тетра-третбутил-4,4?-дифенохинона (дифенохинона II) путем окис-ления 2,6-ди-трет-бутилфенола (монофенола І), в присутствии катализатора, способного к многократной регенерации и легкому отделению от синтезированных продуктов.
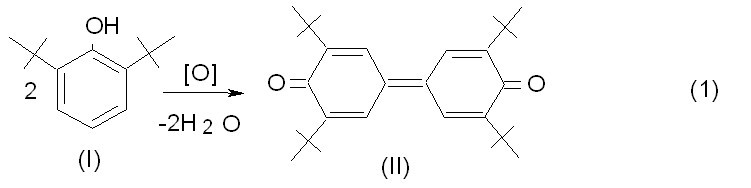
Ранее [2], [3] предложена технология данного синтеза с использованием полимер-ного катализатора КС на основе иммобилизованного фталоцианина кобальта в присутст-вии щелочного промотора КСП. Препятствием для внедрения этой технологии является отсутствие на сегодняшний день промотора КСП. Попытка замены промотора КСП в дан-ной системе концентрированным 60%-ным раствором КОН весьма усложнила технологи-ческий процесс, образующейся густой кашицеобразной смесью фенолятов в присутствии катализатора КС. Это вызвало необходимость поиска альтернативной гетерогенно-каталитической системы, способной к работе в сильнощелочной среде.
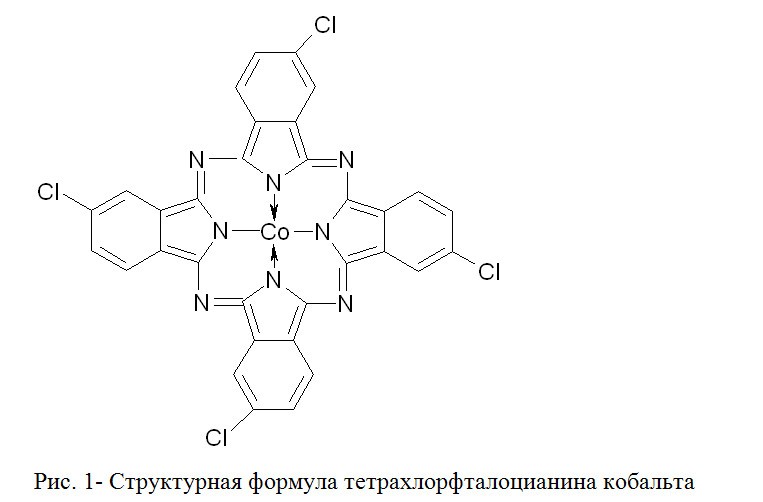
Из ряда испытанных нами активных сульфо- и хлорпроизводных фталоцианина кобальта выбран иммобилизованный на полимерный носитель тетрахлорфталоцианин кобальта (КСТХ), преимуществом которого является нерастворимость в воде, щелочных растворах и углеводородах (см. рис.1), что должно облегчать применение водного раствора КОН с использованием хлорсодержащего фталоцианинового катализатора КСХС.

Проведено сравнительное окисление монофенола (I) техническим кислородом на катализаторе КС с промотором КСП (известная система) и на синтезированном нами гете-рогенном катализаторе КСТХ (тетрахлорфталоцианин кобальта на полимерной основе) с использованием концентрированных водных растворов КОН взамен промотора КСП (предлагаемая система). Установлено (табл.1), что в присутствии предлагаемой системы окисление монофенола (I) протекает более эффективно – за меньший отрезок времени (45 минут против 120 – в известной системе).
Исследование влияния природы и концентрации щелочного агента на скорость окисления монофенола (I) показало более высокую активность растворов КОН по сравне-нию с растворами NaOH.
На рис. 2 приведены кинетические кривые процесса окисления монофенола (I) в растворе толуола (25,0 мл.) кислородом (2,0 л/ч) в присутствии 9,1% масс катализатора КСТХ и 0,8% масс 60%-ного раствора КОН. Из приведенных на рис.2 данных, полученных методом жидкостной хроматографии следует, что время полупревращения монофенола (I) на предлагаемой каталитической системе составляет 19 мин; максимальная стационарная концентрация промежуточного продукта окисления 4,4?-бис(2,6-ди-трет-бутилфенола) – бисфенола (III) составляет до 0,0718 моль/л. Конверсия по монофенолу (І) составляет 100%. Селективность по дифенохинону (II) равна 96,95%. Наряду с основным продуктом образуется до 2,7% побочного продукта (2,6-ди-трет-бутилбензохинон).
Характер кривых расходования монофенола (I) и накопления дифенохинона (II) указывает на то, что данная реакция на конечной стадии протекает с ускорением (рис.2), с увеличением содержания дифенохинона (II) в реакционной смеси до соизмеримых с монофенолом (I) концентраций происходит резкое ускорение реакции окисления монофенола (I) и соответственное возрастание скорости образования дифенохинона (II).

Полученные результаты подтверждаются литературными данными так, известно, что автокаталитический характер кинетических кривых поглощения кислорода, наблюдаемый в процессе окисления некоторых фенолов, обусловлен способностью образующихся при этом хинонов ускорять реакцию окисления фенолов [4]. В работе [5] также указывалось на возможность катализа реакции окисления монофенола (I) дифенохиноном (II). Ранее при исследовании [2] окисления монофенола (I) в системе катализатор КС – промотор КСП было показано, что введение больших количеств дифенохинона (II) в реакционную смесь приводит к существенному ускорению процесса окисления монофенола (I) и повышению селективности до 100%.
На рис.3 представлены кинетические кривые окисления монофенола (I) – 0,5 моль/л кислородом (2,0 л/ч) на катализаторе КСТХ в присутствии 0,8 %масс 60% раствора КОН с добавкой 0.1 моль/л дифенохинона (II) в исходную реакционную смесь.
Из сравнения приведенных на рис. 2 и 3 данных видно, что добавка дифенохинона (II) в исходную реакционную смесь приводит к некоторому ускорению процесса окисле-ния. Если в отсутствие дифенохинона (II) на полный расход монофенола (I) в реакционной смеси необходимо 45 минут (рис.2), то в присутствии дифенохинона (II) лишь 37 минут (рис.3). При добавке дифенохинона (II) процесс окисления монофенола (I) идет с преимущественным образованием целевого продукта – дифенохинона (II) и со значительно меньшим образованием промежуточного продукта – бисфенола (III). При этом практически не образуется побочного продукта — 2,6-ди-трет-бутилбензохинона (VI), который был обнаружен в количестве 2,7% в опытах без добавки дифенохинона (II).
Таким образом, добавка дифенохинона (II) в исходное сырье обеспечивает практически 100%-ную селективность процесса окисления монофенола (I) по выходу дифенохинона (II).

Как следует из данных рис. 2 и 3, при накоплении в реакционной смеси заметных количеств бисфенола (III), скорость окисления монофенола (I) заметно замедляется до полного расходования бисфенола (III) в реакторе. Это свидетельствует о первоочередном окислении бисфенола (III) в реакционной смеси с монофенолом (I), что согласуется с литературными данными [6] о гораздо меньшей энергии активации реакции окисления бисфенола (III).
На основе полученных данных нами разработана принципиальная технологическая схема непрерывного процесса окисления монофенола (I), обеспечивающая возможность получения дифенохинона (II) на стационарном катализаторе КСТХ в присутствии доступного и дешевого водного раствора КОН и позволяющая сократить до минимума образование стоков и выделение вредных выбросов в атмосферу (рис. 4).
Монофенол (I), растворенный в толуоле, подогревается в теплообменнике Т-1 до температуры 850С и по линии 1 направляется на стадию окисления в реактор Р-1, представляющий собой колонный аппарат, заполненный катализатором КСТХ. Катализатор КСТХ изготовлен в виде блоков ячеистой структуры, выполняющих в реакторе одновременно функции эффективной распределительной насадки для воздуха и реакционного раствора. В линию 1 по линии 4 подается необходимое количество 60%-ного раствора КОН. В нижнюю часть реактора под слой катализатора по линии 8 подается воздух с давлением около 0,5 МПа, очищенный от диоксида углерода в емкости Е-2 для увеличения срока службы щелочного раствора и предотвращения забивки трубопроводов и аппаратов карбонатами по реакции 2 и 3:
![]()
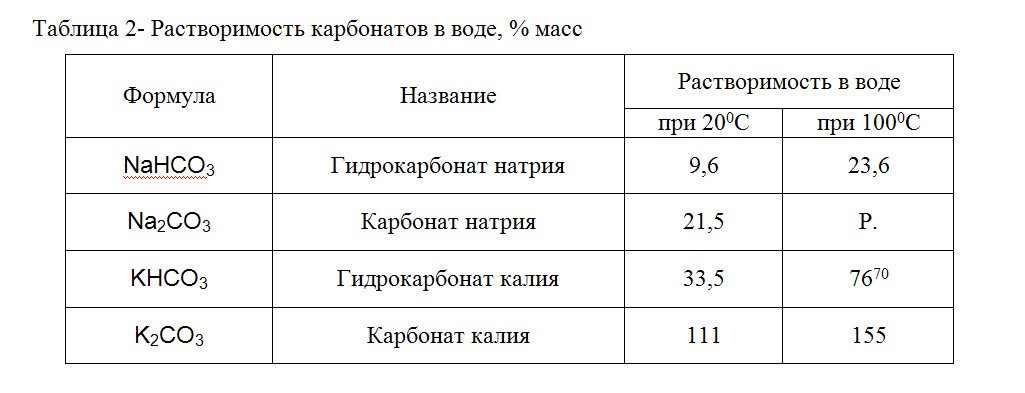
Поскольку растворимость натриевых солей карбоната в воде гораздо ниже растворимости калиевых солей (табл.2), то в качестве абсорбента диоксида углерода из воздуха рекомендуется использовать 10% раствор КОН.
Монофенол (I), проходя через слой катализатора КСТХ в реакторе Р-1, окисляется кислородом воздуха в присутствии концентрированного водного раствора КОН до дифенохинона (II). Кубовая часть реактора служит для осуществления отстоя водно-щелочной фазы от углеводородной. Отстоявшаяся углеводородная фаза боковым отбором по линии 2 направляется на стадию получения бисфенола (III) или на узел выделения дифенохинона (II). Для ускорения реакции окисления монофенола (I) схемой предусмотрен возврат части образующегося дифенохинона (II) в реактор через всасывающую линию 3 смесителя СМ-1, где его смешивают с исходным монофенолом (I).
Отработанный воздух, разбавленный в верхней части реактора азотом для предупреждения образования взрывоопасных смесей, отводится с верха реактора вместе с пара-ми унесенного растворителя на узел отпарки водно-щелочного раствора для отдува из него поглощенной реакционной влаги.
Обводненный раствор щелочи, отбираемый с кубовой части реактора, подогревается в теплообменнике Т-2 и по линии 5 направляется в испаритель поверхностного типа, в котором происходит испарение и отдув избыточной влаги барботажем азото-воздушной смесью. Паро-азото-воздушная смесь по линии 7 направляется через холодильник-конденсатор Х-1 в отстойную емкость Е-3, где отделяется от сконденсировавшихся паров воды и толуола и сбрасывается в печь. Далее под небольшим избыточным давлением жидкость с кубовой части емкости Е-3 поступает на разделение в емкость Е-4, из которой верхом толуол возвращается в процесс на всасывающую линию насоса Н-1, а отстоявшийся водный слой с низа отстойника Е-4 по уровню раздела фаз отводится в канализацию.
Отпаренный от реакционной влаги щелочной раствор охлаждается в холодильнике Х-2 и по линии 6 направляется на всасывающую линию насоса Н-1, подающего щелочной раствор с куба реактора Р-1 в линию 1 подачи монофенола (II) на окисление.

Экспериментальная часть
Изменение концентрации монофенола (I) и продуктов его окисления во времени определяли методом жидкостной хроматографии по изменению площади пиков, соответствующих определяемым компонентам, на хроматографе Spectra-Physics: колонка 250?4,0 мм; Nucleosil – C1810; элюент — ацетонитрил; давление – 0,1 МПа; расход 2,0 мл/мин; УФ детектор, 258 нм.
Окисление 2,6-ди-трет-бутилфенола (I)
Раствор 2,5 г монофенола (I) в 25 мл толуола помещали в реактор периодического действия, перемешивание осуществляли магнитной мешалкой с регулируемым обогревом. Реактор снабжали эффективным обратным холодильником и приспособлением для барботажа кислорода. В реакционную смесь при 850С добавляли гетерогенный катализатор КСТХ — 9,1 % масс и 0,8% масс 60%-ного раствора КОН. Включали подачу кислорода со скоростью 2,0 л/ч и начинали интенсивное перемешивание. Этот момент принимался за начало реакции. Методом тонкослойной и/или жидкостной хроматографии определялось наличие и/или содержание монофенола (II), бисфенола (I), дифенохинона (III) в исследуемых пробах реакционного раствора. По окончании опыта выключались последовательно подача кислорода, магнитная мешалка с обогревом и после 5 минут отстоя углеводородная фаза отделялась от водно-щелочной фазы с гетерогенным катализатором КСТХ. Углеводородную фазу охлаждали до комнатной температуры, выкристаллизовавшийся дифенохинон (III) отделяли от углеводородной фазы на фильтре и сушили на воздухе.
Аналогично проводили окисление монофенола (I) с добавкой дифенохинона (II).
Список литературы
1. Ахмадуллин, Р.М. Особенности стабилизирующего действия фенольного анти-оксиданта 4,4?-бис(2,6-ди-трет-бутилфенол) в процессе старения каучуков. /Р.М. Ахмадуллин, и др. // Каучук и резина. – 2006. — №10. – С. 12-14.
2. Заявка №2000122958/04(024306) Российская Федерация, МПК С07 С 46/06, 50/08. Способ окисления пространственно затрудненных фенолов; заявитель Ахмадуллина А.Г. и др.; заявл. 04.09.2000.
3. Фазлиева Л.К. Использование 3,3?,5,5?-тетра-третбутил-4,4?-дифенохинона в качестве дегидрирующего агента для получения химических добавок к поли-мерным материалам: дис. … канд. хим. наук. /Фазлиева Лилия Канзеловна. – Казань: Изд-во каз. гос. технол. ун-та, 2000. – 100с.
4. Стригун, Л.М. Окисление пространственно-затрудненных фенолов / Л.М. Стри-гун, Л.С.Вартанян, Н.М. Эмануэль // Усл. хим.-1968. — Т.37. — Вып.6. — С.969-997.
5. Журавлева, М. Новые методы получения 3,3?,5,5?-тетратретбутил-4,4?-дифенохинона – полупродукта синтеза 4,4?-бис(2,6-дитретбутилфенола): авто-реф. … канд.хим. наук./ М. Журавлева. – Казань: Изд-во каз. гос. технол. ун-та, 1994. — 17с.
6. Pat. 4482754. 1984. USA. C07 C39/14. Storm R.M. Oxidation of biphenols.