Ахмадуллин Р.М. — автореферат диссертации на соискание степени к.х.н.
На правах рукописи
Смотрите также [PDF формат]
Ахмадуллин Ренат Маратович
НОВЫЕ ГЕТЕРОГЕННО-КАТАЛИТИЧЕСКИЕ СИСТЕМЫ В РЕАКЦИЯХ СИНТЕЗА 4,4?-БИС(2,6-ДИ-ТРЕТ-БУТИЛФЕНОЛА)
02.00.15 – катализ
АВТОРЕФЕРАТ
диссертации на соискание ученой степени кандидата химических наук
Казань — 2009
Работа выполнена на кафедре «Технология синтетического каучука»
Казанского государственного технологического университета
Научный руководитель: доктор химических наук, профессор Мукменева Наталия Александровна
Официальные оппоненты:
доктор химических наук, профессор Харлампиди Харлампий Эвклидович
кандидат химических наук Галкина Ирина Васильевна
Ведущая организация: Институт органической и физической химии им. А.Е. Арбузова Казанского научного центра РАН.
Защита состоится «11» декабря 2009 года в 15.00 часов на заседании диссертационного совета Д 212.080.07 при Казанском государственном технологическом университете по адресу: ул. Сибирский тракт, 12, Казань, 420015, Д-414.
С диссертацией можно ознакомиться в научной библиотеке Казанского государственного технологического университета. Электронный вариант автореферата размещен на сайте Казанского государственного технологического университета http://www.kstu.ru
Автореферат разослан « 08 » ноября 2009 г.
Ученый секретарь диссертационного совета, кандидат химических наук, доцент Захаров В.М.
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы. Обеспечение независимости отечественного производства синтетических каучуков от импортных поставок антиоксидантов, разработка безотходных способов их получения и улучшение экологической составляющей, как самих антиоксидантов (АО), так и технологии их производства — являются важными и актуальными научно-техническими задачами.
В настоящее время для защиты от старения каучуков общего назначения (СКИ, СКД и др.), в основном, применяются соединения из класса аминов и фенолов. Применение токсичных аминных антиоксидантов ведет к ухудшению экологической составляющей стабилизируемого материала, а введение промышленного фенольного антиоксиданта АО-2246 (2,2-метилен-бис-(4-метил-6-трет-бутилфенол)) не обеспечивает достаточно надежную антиокислительную стабильность полимерных продуктов.
Большой теоретический и практический интерес с этих позиций пред-ставляет 4,4?-бис(2,6-ди-трет-бутилфенол) – бисфенол (I), сырьем для производства которого является 2,6-ди-трет-бутилфенол – монофенол (II), получаемый Стерлитамакским опытно-промышленным нефтехимическим заводом. По заключению Всероссийского научно-исследовательского института синтетического каучука (ВНИИСК) имени С.В. Лебедева бисфенол (I) является единственным фенольным антиоксидантом, способным обеспечить эффективную защиту от старения каучука СКИ-3.
Известные к настоящему времени методы синтеза бисфенола (I) осуществляются с использованием гомогенных катализаторов и сопряжены с высокими расходами реагентов, растворителей и образованием большого количества стоков. Несмотря на безусловную полезность и перспективность использования как бисфенола (I), так и промежуточного продукта его синтеза — 3,3?,5,5?-тетра-третбутил-4,4?-дифенохинона – дифенохинона (III), наличие отечественной сырьевой базы для их синтеза, промышленное производство этих антиоксидантов в России до сих пор не реализовано.
Целью настоящей работы явилось создание экологичных и эконо-мичных способов синтеза дифенохинона (III) и бисфенола (I) на основе раз-работки новых эффективных гетерогенно-каталитических систем, определение кинетических и термодинамических характеристик реакций синтеза данных антиоксидантов и оценки эффективности стабилизирующего действия бисфенола (I), дифенохинона (III) и их смесей, полученных на новых катализаторах в условиях термоокисления каучуков.
Научная новизна работы. Разработаны новые подходы к созданию щелочных гетерогенных катализаторов в окислительно-восстановительных реакциях пространственно затрудненных фенолов путем формирования гидрофобизирующего защитного слоя на поверхности твердого гидроксида натрия с использованием 2,6-ди-трет-бутилфенола и оксидов металлов переменной валентности. Методами просвечивающей электронной микроскопии и сканирующей электронной микроскопии охарактеризована морфология новых катализаторов, размер и полидисперсность частиц гидроксидов щелочных металлов (от 150 до 1300 нм), покрытых гидрофобной оболочкой.
Выявлены кинетические закономерности реакций жидкофазного окисления и восстановления пространственно затрудненных фенолов на новых катализаторах с анализом состава реакционных растворов методами жидкостной и тонкослойной хроматографии.
Совокупность полученных результатов позволяет предложить новые, регенеративные и безотходные способы получения 3,3?,5,5?-тетра-третбутил-4,4?-дифенохинона и 4,4?-бис(2,6-ди-третбутилфенола).
Практическая значимость работы. Новые гетерогенно-каталитические системы, созданные на основе доступного отечественного сырья являются эффективными как в реакциях окисления пространственно затрудненных фенолов, так и при их восстановлении из дифенохинонов, устойчивыми к воздействию реакционной влаги на стадии окисления и к механическому износу при их непрерывной циркуляции в системе синтеза.
Экспериментально подтверждена эффективность полученных с применением новых катализаторов 4,4?-бис(2,6-ди-третбутил-фенола), 3,3?,5,5?-тетра-трет-бутил-дифенохинона и их смесей в условиях термоокисления каучуков. Обоснована целесообразность их промышленного производства.
Апробация работы. Основные результаты диссертационной работы докладывались на международной конференции ICAMES ‘ 2004 (Istanbul), на XIII-ой международной конференции молодых ученых, студентов и аспирантов 2009 (Казань) и на ежегодных отчетных научных сессиях Казанского государственного технологического университета (Казань — 2007, 2008 гг.).
Публикации. Основные результаты работы изложены в трех статьях журналов, рекомендованных ВАК.
Объем и структура работы. Диссертационная работа изложена на 151 страницах машинописного текста, включает 94 рисунка, 19 таблиц и список литературы из 99 ссылок. Работа состоит из введения, трех глав, выводов и списка литературы.
Первая глава содержит литературный обзор, в котором рассмотрены достоинства и недостатки известных способов получения 4,4?-бис(2,6-ди-трет-бутилфенола) и 3,3?,5,5?-тетра-третбутил-4,4?-дифенохинона с исполь-зованием различных гомогенных и гетерогенных каталитических систем. Проведен критический анализ свойств известных катализаторов окислительно-восстановительных реакций алкилированных фенолов.
Во второй главе обсуждены и реализованы теоретические и экспери-ментальные подходы к созданию новых гетерогенно-каталитических систем, устойчивых к воздействию реакционной влаги и механическому износу при непрерывной циркуляции дисперсии катализатора в процессе синтеза 4,4?-бис(2,6-ди-трет-бутилфенола).
Представлены данные, характеризующие кинетические закономерно-сти жидкофазного окисления и восстановления пространственно затрудненных фенолов в присутствии новых гетерогенно-каталитических систем, результаты физико-химического исследования их состава, дисперсности, морфологии и каталитических свойств в реакциях синтеза 3,3?,5,5?-тетра-трет-бутил-4,4?-дифенохинона и 4,4?-бис(2,6-ди-трет-бутилфенола).
В третьей главе приведены экспериментальные методики синтеза раз-работанных катализаторов и исследования их состава и морфологии, методики проведения окислительно-восстановительных реакций пространственно затрудненных фенолов и изучения кинетики этих реакций, методики испытания эффективности стабилизирующих свойств фенольных АО, синтезированных с применением новых катализаторов, а также способы определения кинетических и термодинамических параметров реакций.
ОСНОВНОЕ СОДЕРЖАНИЕ РАБОТЫ
1. Разработка и исследование катализаторов синтеза 3,3?,5,5?-тетра-трет-бутил-4,4?-дифенохинона и 4,4?-бис(2,6- ди-трет-бутилфенола)
На основании анализа свойств известных щелочных катализаторов окислительно-восстановительных реакций замещенных фенолов найдены пути повышения активности и стабильности твердого щелочного катализатора (NaOH) в синтезе 3,3?,5,5?-тетра-трет-бутил-4,4?-дифенохинона (III) и 4,4?-бис(2,6- ди-трет-бутилфенола) (I), протекающем по реакциям 1-3:
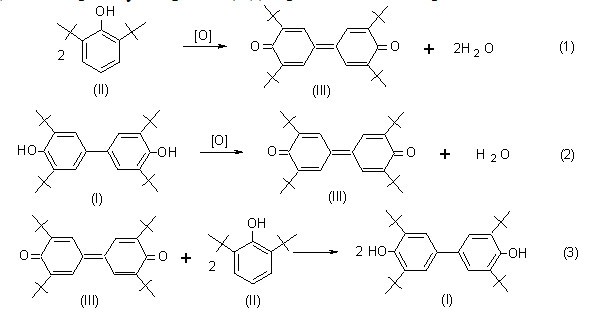
Для предотвращения дезактивации щелочного катализатора реакционной водой, выделяющейся по реакциям 1 и 2, разработана и реализована методика гидрофобизации поверхности частиц катализатора алкилированным монофенолом (II). Экспериментально установлено, что модификация поверхности твердого гидроксида натрия алкилированным фенолятом приводит к получению нового гетерогенного щелочного катализатора КГЩ, обладающего значительно более высокой активностью и стабильностью при окислении пространственно затрудненных фенолов (I), (II) по сравнению с известным катализатором — твердым гидроксидом натрия (рис.1 и 2).
Экранированный фенолятом катализатор КГЩ, в отличие от твердого гидроксида натрия, не поглощает реакционную влагу, накапливающуюся в растворителе. Снижение каталитической активности КГЩ в течение 10 циклов, проведенных на возвратном толуоле, составило не более 9,1% отн. (рис.1), в то время как незащищенный фенолятами гидроксид натрия в этих условиях поглотил реакционную влагу, перейдя из твердого состояния в жидкое, существенно снизив при этом свою активность. Кроме того, экранирование щелочи в КГЩ предотвращает образование в реакционной системе фенолята натрия, приводящего к торможению процесса окисления в начале реакции (рис.2).
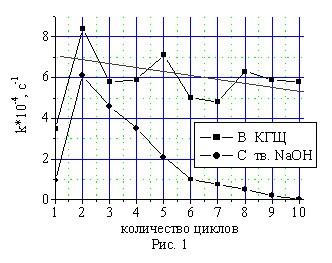
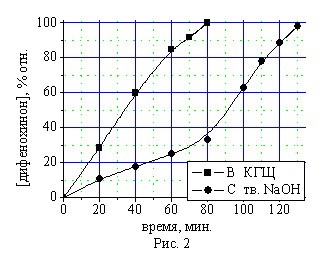
Рис. 1. Сравнение стабильности катализаторов КГЩ и твердого NaOH в реакции окисления монофенола (II) в течение 10 циклов.
Рис. 2. Окисление монофенола (II) в присутствии катализатора КГЩ и твердого гидроксида натрия.
При проведении более длительных экспериментов (более 10 циклов) на катализаторе КГЩ было замечено, что со временем происходит увеличение его объема в реакторе и ухудшение осаждения его частиц в реакционной среде, по-видимому, за счет механического разрушения катализатора КГЩ на более мелкие частицы с формированием незащищенных гидрофобным слоем фенолятов поверхностей NaOH, которые становятся доступными для молекул реакционной воды.
Как видно из снимков катализатора КГЩ (рис.3), выполненных мето-дом просвечивающей электронной микроскопии, КГЩ состоит из частиц псевдоглобулярной формы размером от 150 до 1300 нм, окантованных полупрозрачным просветленным поверхностным слоем фенолятов натрия, внутри которых просматриваются темные включения частиц твердого гидроксида натрия. Катализатор КГЩ на рис.3 представлен агломератами, состоящими из 3-х частиц КГЩ, одиночной, либо сдвоенной частицами, что косвенно подтверждает механическое разрушение его частиц в процессе эксплуатации.
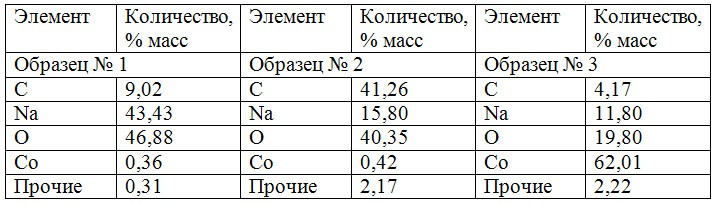
Об этом же свидетельствуют результаты фазового элементного анализа поверхности частиц катализатора КГЩ, выполненные с помощью сканирующего электронного микроскопа (рис.4 и табл.1).
Наличие углерода, обнаруженного в результате фазового анализа поверхностного слоя КГЩ (табл.1), указывает на присутствие в нем углеводородной (гидрофобной) фазы. Различное же соотношение содержания углерода и натрия на поверхности различных образцов КГЩ подтверждает образование неэкранированных фенолятами участков поверхности катализатора в местах разлома (см. образец 1 в табл.1).
Рис.3. Изображение катализатора КГЩ (увеличение 103000 и 115000), полученное методом просвечивающей микроскопии.

Рис. 4. Изображение поверхности катализатора КГЩ, полученное методом сканирующей микроскопии.
Таблица 1 Элементный анализ состава поверхностного слоя катализатора КГЩ

К таким участкам КГЩ, не защищенным гидрофобным слоем фенолятов, открывается свободный доступ молекулам реакционной воды и, как следствие, возможность их взаимодействия со щелочью, сопровождающегося увеличением объема КГЩ.
С целью повышения стабильности и активности катализатора КГЩ в его состав были введены оксиды металлов переменной валентности (ти-тана, ванадия, хрома, марганца, железа, кобальта никеля, меди, цинка и алюминия) для получения новых катализаторов типа КГЩМе.
Введение оксидов металлов 3d-элементов в катализатор КГЩ показало двухпиковую картину изменения активности катализаторов КГЩМе в реакциях окисления монофенола (II), согласующуюся с теорией кристаллического поля. Из рис.5 видно, что максимальная активность при окислении монофенола (II) проявляется в случае модификации КГЩ ок-сидом кобальта Co3O4 и оксидом меди СuO (d6-9-элементами).
В реакции дегидрирования монофенола (II) дифенохиноном (III) оксиды металла в составе катализатора КГЩМе показали иную картину распределения активностей, где наиболее активными оказались катализаторы, модифицированные TiO2, Fe2O3 и Al2O3 (рис.6).
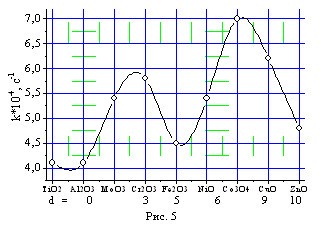
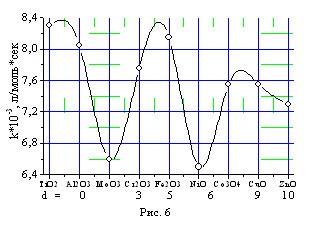
Рис. 5, 6. Влияние природы оксида металла (Ме) в составе катализатора КГЩМе на скорость реакции окисления монофенола (II) (рис. 5) и скорость реакции дегидрирования монофенола (II) дифенохиноном (III) (рис. 6)
Представленные выше результаты показывают, что среди изученных катализаторов КГЩМе наибольший интерес представляют катализаторы, модифицированные двуокисью титана — КГЩTi и оксидом кобальта — КГЩСо.
Изучение влияния природы щелочного металла в составе катализатора КГЩTi в реакциях окисления монофенола (II) (рис. 7) и дегидрирования монофенола (II) дифенохиноном (III) (рис. 8) свидетельствует о более высокой активности гидроксида натрия.
Как видно из табл.2, модификация структуры КГЩ двуокисью титана приводит к стабилизации его каталитической активности и исходного объема при многократном использовании, а также к значительному улучшению осаждения катализатора КГЩTi из реакционной системы. При достижении критической концентрации воды в толуоле скорость окисления монофенола (II) заметно снижается. После отгонки реакционной воды из толуола активность катализатора КГЩTi полностью восстанавливается. Из приведенных данных очевидно, что для стабилизации кинетических параметров процесса окисления фенолов на катализаторе КГЩTi необходима периодическая или непрерывная регенерация растворителя, в частности, путем азеотропной отгонки из него реакционной воды, т.к. накопление воды в системе приводит к тор-можению окисления фенолов.
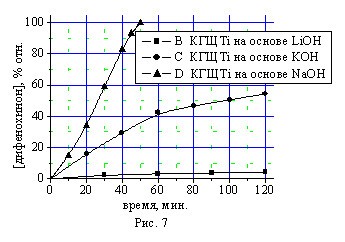
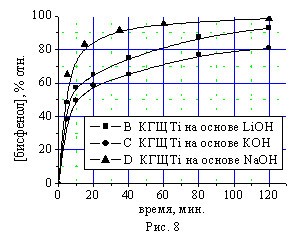
Рис. 7, 8. Влияние природы металла щелочного агента в составе катализатора КГЩTi в реакциях окисления монофенола (II) (рис. 7) и дегидрирования монофенола (II) дифенохиноном (III) (рис. 8).
Таблица 2. Исследование стабильности работы катализатора КГЩTi

Эксперименты по определению времени осаждения катализатора КГЩTi размером от 150 нм до 1300 нм в углеводородных средах, таких, как толуол и декан, показали их полное осаждение в течение 15?30 мин. Изучение влияния размера частиц КГЩTi выявило линейную зависимость увеличения скорости окисления монофенола (II) от снижения среднего размера частиц катализатора (рис.9). Однако, снижение среднего размера частиц КГЩTi с 600 до 500 нм привело к увеличению времени осаждения с 15 до 30 минут. Поэтому в дальнейшем применяли частицы КГЩ, средний размер которых составлял не менее 600 нм.
При исследовании образцов катализатора КГЩTi методом просвечи-вающей электронной микроскопии выявлено образование частиц твердого гидроксида натрия, покрытых защитным гидрофобным слоем (рис.10).
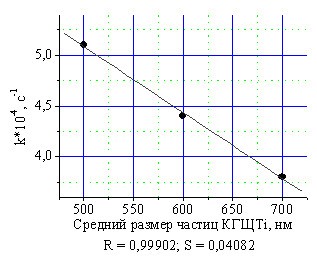
Рис. 9. Зависимость скорости окисления монофенола (II) от среднего размера частиц катализатора КГЩTi.
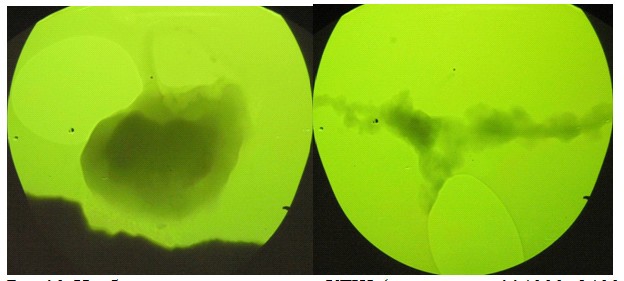
Рис.10. Изображение катализатора КГЩ (увеличение 114000, 24000), полученное методом просвечивающей микроскопии.
Дополнительное изучение гидрофобного углеводородного слоя образцов катализатора КГЩTi методом сканирующей электронной микроскопии подтвердило, как и в случае катализатора КГЩ, наличие углерода в элементном составе поверхностного слоя (табл. 3). Содержание натрия составляет от 1,89 до 16,33 % вес, что ниже, чем в катализаторе КГЩ (от 7,70 до 42,50 % вес). Это свидетельствует о более полном заполнении поверхности твердого гидроксида натрия в КГЩTi гидрофобным слоем, включающем в себя как органическую состав-ляющую в виде фенолята натрия, так и неорганическую составляющую — в виде пленки метатитаната.
По расходу монофенола (II) в синтезе катализатора КГЩTi экспери-ментально установлено, что для гидрофобизации поверхности 1,0 г катализатора КГЩTi необходимо в среднем 0,035 г монофенола (II).
Анализ образцов катализатора КГЩСо с использованием сканирующего электронного микроскопа показал (рис.11 и табл.3) наличие кобальта во всех анализируемых точках. Различное содержание натрия в поверхностном слое гетерогенного катализатора (от 11,80 до 43,43 % вес) свидетельствует о неравномерном заполнении поверхностного слоя. Места скопления оксида кобальта на снимках (рис. 11) характеризуются яркими свечениями.

Рис. 11. Изображение поверхности катализатора КГЩСо, полученное методом сканирующей микроскопии.
Таблица 3 Элементный анализ состава поверхностного слоя катализатора КГЩTi

Таблица 4 Элементный анализ состава поверхностного слоя катализатора КГЩСo
Исследование влияния концентрации оксида кобальта в составе катализатора КГЩСо на его эффективность в реакции окисления монофенола (II) и оксида титана в составе катализатора КГЩTi в реакции дегидрирования монофенола (II) дифенохиноном (III) показало экстремальный (гиперболический) характер полученных зависимостей (рис. 12, 13), из которых следует, что оптимальное количество оксида кобальта в КГЩСо находится в пределах от 7,0 до 12,0 % масс, а оксида титана в КГЩTi от 7,0 до 10,0 % масс.
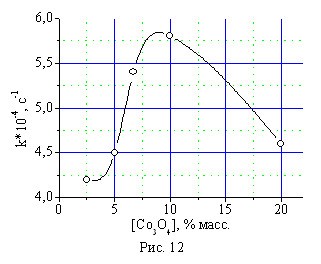
Рис. 12. Влияние концентрации Со3О4 в составе катализатора КГЩСо на скорость окисления монофенола (II).
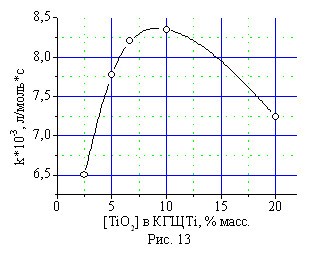
Рис. 13. Влияние концентрации TiO2 в составе катализатора КГЩTi на скорость образования бисфенола (I).
2. Кинетические закономерности реакций жидкофазного окисления 2,6-ди-трет-бутилфенола (II) и 4,4?-бис(2,6- ди-трет-бутилфенола) (I) молекулярным кислородом в присутствии катализаторов КГЩTi и КГЩСо
Проведено кинетическое исследование синтеза дифенохинона (III) при различных начальных концентрациях монофенола (II) и бисфенола (I) в присутствии 4,0 % масс катализатора КГЩTi (рис. 14, 16) и 2,0% масс катализатора КГЩСо (рис. 15, 17) при 90 0С представленное на рис. 14-17.
Дифференциальным методом определены концентрационные порядки реакций по бисфенолу (I) и монофенолу (II) в присутствии катализаторов КГЩTi и КГЩСо. Полученный дробный порядок реакции по бисфенолу (I), равный 0,5, хорошо согласуется с первым порядком по монофенолу (II) с учетом количества гидроксильных групп: у бисфенола (I) их две, а у монофенола (II) – одна.

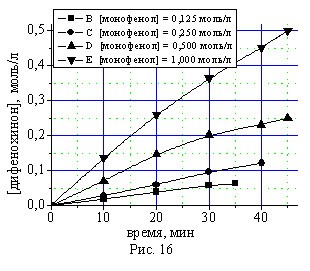
Рис. 14, 15. Кинетические кривые окисления монофенола (II) в присут-ствии катализаторов КГЩTi и КГЩСо.
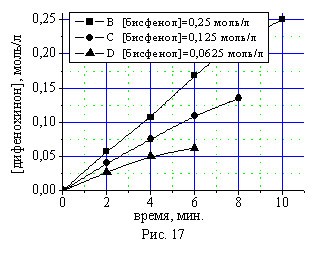
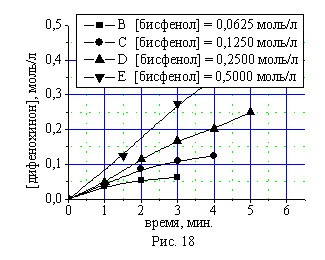
Рис. 16, 17. Кинетические кривые окисления бисфенола (I) в присутст-вии катализаторов КГЩTi и КГЩСо.
Кривые окисления монофенола (II) в полулогарифмических координатах не линеаризуются, что говорит о влиянии продукта реакции — дифенохинона (III) на скорость окисления исходного фенола. Исследование влияния дифенохинона (III) на скорость окисления монофенола (II) и бисфенола (I) подтвердило автокаталитический характер протекания данной реакции (рис.18, 19). В присутствии катализатора КГЩTi зависимость имеет вид кривой с насыщением, а в случае катализатора КГЩСо — зависимость линейная.
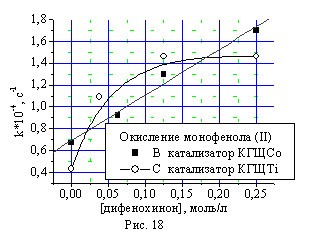
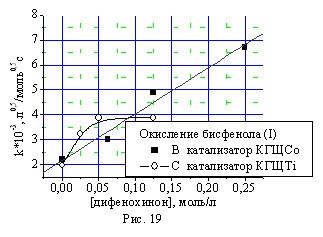
Рис. 18, 19. Влияние дифенохинона (III) на константы скорости окисления монофенола (II) и бисфенола (I).
Показано, что зависимость скорости окисления монофенола (II) (рис. 20) и бисфенола (I) (рис. 21) от концентрации катализаторов КГЩTi и КГЩСо хорошо описывается прямой, что свидетельствует о первом порядке реакции по обоим катализаторам.
Зависимость эффективной константы скорости реакции окисления фе-нолов (I) и (II) от концентрации кислорода в газе-окислителе в присутствии катализатора КГЩTi имеет вид кривой с насыщением. Обработка получен-ных результатов в координатах эффективной константы скорости реакции от обратной концентрации кислорода в газе-окислителе показывает, что расчетные точки хорошо укладываются на прямую (рис. 22, 23).

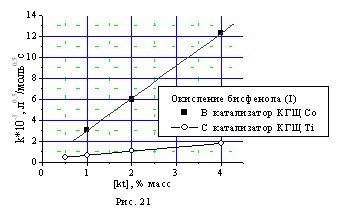
Рис. 20, 21. Зависимость констант скорости окисления монофенола (II) и бисфенола (I) от концентрации катализаторов КГЩTi и КГЩСо.
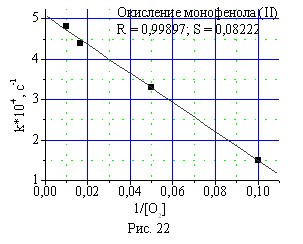
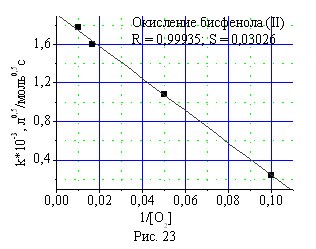
Рис. 22, 23. Зависимость эффективной константы окисления монофенола (II) и бисфенола (I) от обратной концентрации кислорода в газе-окислителе.
Исследование влияния температуры на скорость окисления монофенола (II) и бисфенола (I) техническим кислородом показало увеличение скорости окисления реагентов с ростом температуры для обоих катализаторов (рис. 24, 25). Однако в случае катализатора КГЩСо скорость окисления монофенола (II) и бисфенола (I) растет быстрее, чем с катализатором КГЩTi.
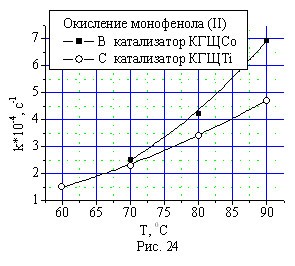
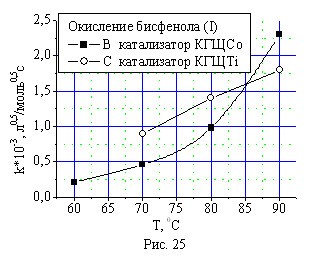
Рис. 24, 25. Зависимость скорости окисления монофенола (II) и бисфе-нола (I) от температуры в присутствии катализаторов КГЩTi и КГЩСо.
Зависимость константы скорости окисления монофенола (II) и бисфе-нола (I) от температуры в координатах Аррениуса по углу наклона прямой показывает, что энергия активации в случае более активного катализатора КГЩСо выше, чем в присутствии катализатора КГЩTi (рис. 26, 27).
Полученные результаты можно объяснить низкой активностью оксида кобальта при пониженных температурах и значительным по-вышением его активности с увеличением температуры (см. рис.24, 25). Это связано с экспоненциальным ростом электропроводности в полупроводниках – оксидах металлов при повышении температуры, т.е. с ростом температуры увеличивается электронная проводимость оксидов металлов, а, следовательно, и их каталитическая активность в реакциях электронного переноса.
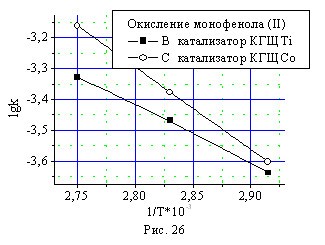

Рис. 26, 27. Зависимость констант скорости окисления монофенола (II) и бисфенола (I) от температуры в координатах Аррениуса.
Из приведенных данных видно, что каталитическая реакция окисления бисфенола (I) протекает намного быстрее, нежели окисление монофенола (II). Из теории активированного комплекса известно, что чем ниже скорость реакции, тем выше энергия активации (энтальпия активации). Данные расчетов энтальпии активации этих реакций в присутствии катализатора КГЩTi, приведенные в табл. 5, хорошо согласуются с этим утверждением. Однако, в присутствии более активного катализатора КГЩСо энтальпия активации в реакции окисления бисфенола (I) составляет значительно большую величину (78,5 кДж/моль), чем при окислении монофенола (II) (50,7 кДж/моль). Полученные данные можно интерпретировать только с учетом величин энтропии активации этих реакций.
Так, из табл. 5 видно, что при переходе от катализатора КГЩTi к КГЩСо при окислении монофенола (II) энтропия активации увеличивается с -213 до -167 Дж/(моль•К), а в случае окисления бисфенола (I) с -216 до -81 Дж/(моль•К). Это свидетельствует об образовании более высокоупорядоченных активированных комплексов в присутствии катализатора КГЩTi. При учете обоих факторов — энтальпийного и энтропийного, видно, что свободная энергия Гиббса реакций окисления фенолов (I) и (II), катализируемых КГЩСо, несколько ниже в сравнении с таковой в присутствии КГЩTi.
Таблица 5 Сравнение термодинамических параметров реакций окисления монофенола (II) и бисфенола (I) на катализаторах КГЩTi и КГЩСо.

3. Кинетические закономерности реакции жидкофазного дегидрирования 2,6-ди-трет-бутилфенола 3,3?,5,5?-тетра-трет-бутил-дифено-хиноном в присутствии катализатора КГЩTi
Кинетические кривые синтеза бисфенола (I) в присутствии 0,5 % масс катализатора КГЩTi при температуре 1700С при различных начальных концентрациях дифенохинона (III) приведены на рис. 28. Определение концентрационного порядка реакции по дифенохинону (III) подтвердило 2-ой порядок реакции как дифференциальным (рис. 29) методом по логарифмической зависимости начальной скорости расходования дифенохинона (III) от его исходной концентрации, так и интегральным (рис. 30) методом по зависимости обратных концентраций дифенохинона (III) от времени.
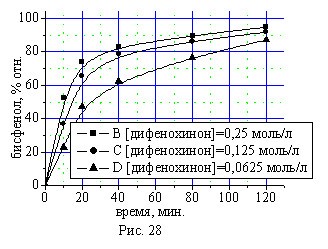

Рис. 28. Зависимость выхода бисфенола (I) от концентрации исходного дифенохинона (III).
Рис. 29. Логарифмическая зависимость скорости расходования дифенохинона (III) от его начальной концентрации в координатах lg(dА/dt) от lg[A0].
При изучении влияния концентрации катализатора КГЩTi в реакции дегидрирования монофенола (II) дифенохиноном (III) был обнаружен эффект критической концентрации (рис. 31), когда дальнейшее увеличение количества катализатора в реакционной смеси выше 0,25% масс не приводило к ускорению реакции.
Данные по влиянию температуры на выход бисфенола (I) свидетельствуют об ускорении реакции с ростом температуры (рис. 32). Расчет энергии активации по тангенсу угла наклона кривой зависимости lgk от 1/T (рис. 33) показал, что ЕА = 182,3 кДж/моль, а предэкспоненциальный множитель равен 6,8?1018 л/моль•с.
Анализ полученных кинетических данных позволяет определить ос-новные параметры реакции дегидрирования монофенола (II) дифенохиноном (III) с применением катализатора КГЩTi: необходимое количество катализатора КГЩTi не более 0,25% масс, оптимальная температура 1800С.
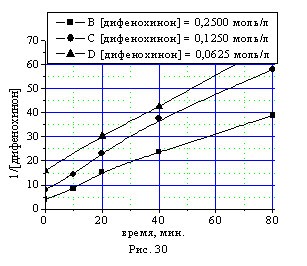
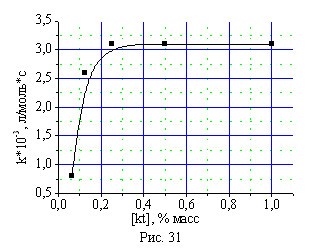
Рис. 30. Анаморфозы в координатах 1/[дифенохинон], ?
Рис. 31. Зависимость скорости синтеза бисфенола (I) от концентрации катализатора в системе.
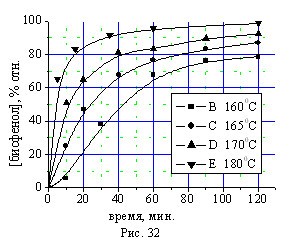

Рис. 32. Влияние температуры на синтез бисфенола (I).
Рис. 33. Зависимость lgk от 1/T в реакции синтеза бисфенола (I)
4. Изучение стабилизирующего действия 4,4?-бис(2,6-ди-трет-бутилфенола)
Для бисфенола (I) и дифенохинона (III), полученных с применением разработанных нами новых гетерогенных щелочных катализаторов КГЩМе, оценена эффективность стабилизации ими эластомеров.
Таблица 6. Физико-механические показатели каучука СКИ-3 до и после старения (1400С, 90 мин) в присутствии антиоксидантов

Таблица 7. Физико-механические показатели каучука СКД-Н до и по-сле старения (1400С, 120 мин.) в присутствии антиоксидантов
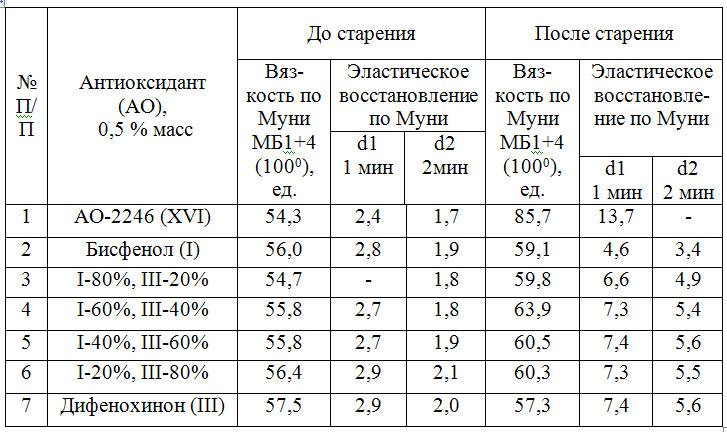
Как видно из табл. 6, 7, в каучуке СКИ-3 эффективно применение как бисфенола (I), так и дифенохинона (III), а также смесей на их основе, кото-рые обеспечивают сохранение физико-механических свойств СКИ-3 на уровне широко применяемого в промышленности аминного антиоксиданта Дусантокс-L и существенно превосходят по стабилизирующим свойствам известный фенольный антиоксидант АО-2246. Из табл. 7 видно, что дифенохинон (III) превосходит АО-2246 и при стабилизации каучука СКД-Н.
Предложена циклическая схема стабилизирующего действия бисфенола (I) и дифенохинона (III), включающая их взаимные превращения в процессе ингибирования термоокислительной деструкции полимеров.
Данные физико-механических испытаний подтверждают высокую эф-фективность как бисфенола (I), так дифенохинона (III) и смесей на их основе при ингибировании термоокислительного старения каучуков, актуальность и целесообразность их промышленного производства на отечественном сырье с применением разработанных новых гетерогенно-каталитических систем.
ВЫВОДЫ
1. Разработаны новые гетерогенные щелочные катализаторы на основе модифицированного 2,6-ди-трет-бутилфенолом твердого гидроксида натрия и оксидов металлов 3d-элементов, обладающие высокой активностью и селективностью в реакциях окисления 2,6-ди-трет-бутилфенола и 4,4?-бис(2,6-ди-трет-бутилфенола) и в реакции дегидрирования 2,6-ди-трет-бутилфенола 3,3?,5,5?-тетра-трет-бутил-дифенохиноном.
2. С применением современных физико-химических методов исследования охарактеризована морфология полученных гетерогенных щелочных катализаторов, представляющих собой, твердые полидисперсные частицы размером от 150 до 1300 нм, покрытые гидрофобным слоем на основе 2,6-ди-трет-бутилфенолятов, устойчивые к гидролизу и стабильные в условиях реакционных процессов.
3. Выявленные кинетические параметры гетерогенно-каталитических реак-ций жидкофазного окисления молекулярным кислородом 2,6-ди-трет-бутил-фенола и 4,4?-бис(2,6-ди-трет-бутилфенола) и реакции дегидрирова-ния 2,6-ди-трет-бутилфенола 3,3?,5,5?-тетра-трет-бутил-дифенохиноном подтвердили высокую каталитическую активность разработанных катализаторов.
4. Установлена высокая эффективность стабилизирующего действия 4,4?-бис(2,6-ди-трет-бутилфенола), 3,3?,5,5?-тетра-трет-бутил-дифенохинона и их смесей, полученных на новых катализаторах, в условиях термоокисления каучуков.
5. Проведенные исследования подтвердили возможность направленного формирования катализаторов заданного состава, обуславливающих их высокую активность в окислительно-восстановительных реакциях пространственно затрудненных фенолов.
6. Полученные результаты по разработке нового способа синтеза фенольных антиоксидантов на базе модифицированных щелочных катализаторов позволяют обосновать актуальность и целесообразность их промышленного производства на доступном отечественном сырье.
Основное содержание диссертации изложено в следующих работах
Статьи и журналы, рекомендованные ВАК РФ
1.Бухаров, С.В. Окисление 3,5,3?,5?-тетра-трет-бутил-4,4?-дигидрокси-бифенила кислородом воздуха в отсутствии щелочных катализаторов / С.В. Бухаров, Л.К. Фазлиева, Н.А. Мукменева, Р.М. Ахмадуллин, В.И. Морозов //ЖОХ. – 2002. – Т.72.- вып. 11. – С. 1910-1912.
2. Ахмадуллин, Р.М. Особенности стабилизирующего действия фенольного антиоксиданта 4,4?-бис(2,6-ди-трет-бутилфенол) /Р.М. Ахмадуллин, Г.Н. Нугуманова, Н.А. Мукменева, С.В. Бухаров и др. // Каучук и резина. — 2006. — №10. — С.14-17.
3. Ахмадуллин, Р.М. Гетерогенно-каталитическое окисление 2,6-ди-трет-бутилфенола до 3,3?,5,5?-тетра-третбутил-4,4?-дифенохинона с использова-нием полимерного катализатора на основе тетрахлорфталоцианина кобальта / Р.М. Ахмадуллин, С.И. Агаджанян, Н.А. Мукменева, А.Г. Ахмадуллина // Вестник казанского технологического университета. – 2009. – №2. – С. 64-70.
Тезисы докладов научных конференций
1. Ахмадуллин, Р.М. Особенности стабилизирующего действия фенольного антиоксиданта 4,4?-бис(2,6-ди-трет-бутилфенол) / Р.М. Ахмадуллин, А.Ш. Зиганшин, Н.А. Мукменева // Тез. докл. 10 международной студенческой конференции инженеров, Стамбул, 2004. С.75-79.
2. Ахмадуллин, Р.М. Новые гетерогенно-каталитические системы в реакциях синтеза 4,4?-бис(2,6-ди-трет-бутилфенола) / Р.М. Ахмадуллин, А.Г. Ахмадуллина, С.И. Агаджанян, Н.А. Мукменева // Тез. докл. XIII-ая международная конференция молодых ученых, студентов и аспирантов, Казань, 2009. С.26.
Работа выполнена в рамках реализации ФЦП «Научные и научно-педагогические кадры инновационной России» на 2009-2013 годы, ГК № П478
Заказ 60 Тираж 100 экз.
Офсетная лаборатория Казанского государственного Технологического университета 420015, Казань, К.Маркса, 68